题目内容
某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)?cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):

分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,此反应的△S 0(填“>”或“<”),由此判断,此反应自发进行,必须满足的条件是 .
(2)在图象反应Ⅱ中,T1 T2(填“>”“<”或“=”),该正反应为 (填“吸热”或“放热”)反应.
(3)在图象反应Ⅲ中,若T1>T2,则该反应 (填“能”或“不能”)自发进行.

分析图象,回答下列问题:
(1)在图象反应Ⅰ中,若p1>p2,则此正反应为
(2)在图象反应Ⅱ中,T1
(3)在图象反应Ⅲ中,若T1>T2,则该反应
考点:物质的量或浓度随时间的变化曲线,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,△H<0;恒定温度时压强越大,α(A)越大,说明此a+b>c,即为熵减反应,△S<0;放热、熵减反应只能在低温下自发进行;
(2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应;
(3)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H-T△S>0,反应不能自发进行.
(2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应;
(3)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H-T△S>0,反应不能自发进行.
解答:
解:(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0.放热、熵减反应只能在低温下自发进行,
故答案为:放热;<;低温;
(2)反应Ⅱ中先拐先平温度高,T1温度下反应先达到平衡状态,说明T1>T2;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,
故答案为:>;放热;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1>T2,恒压下温度越高α(A)越小,说明升高温度平衡向左移动,正反应为放热反应,△H<0,则△H-T△S<0,反应能自发进行,
故答案为:能.
故答案为:放热;<;低温;
(2)反应Ⅱ中先拐先平温度高,T1温度下反应先达到平衡状态,说明T1>T2;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0,
故答案为:>;放热;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1>T2,恒压下温度越高α(A)越小,说明升高温度平衡向左移动,正反应为放热反应,△H<0,则△H-T△S<0,反应能自发进行,
故答案为:能.
点评:本题涉及图象的分析及化学平衡的移动和反应进行的方向等知识点,整合性较强,通过图象中数据的变化判断化学平衡移动的方向是解题的关键,题目难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列化学用语或者说法正确的是( )
| A、2mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 |
B、铵根离子的结构式: |
| C、谷氨酸的熔点高达205℃,主要是因为晶体中羧基与氨基之间形成较强的氢键 |
| D、常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
为了有效除去工业食盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为( )
| A、NaOH-Na2CO3-BaCl2 |
| B、NaOH-BaCl2-Na2CO3 |
| C、BaCl2-NaOH-Na2CO3 |
| D、Na2CO3-BaCl2-NaOH |
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.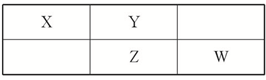 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍. 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.