题目内容
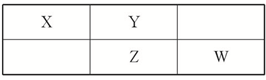 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.请回答下列问题:
(1)元素Y位于周期表中第
(2)这四种元素的氢化物中,水溶液碱性最强的氢化物电子式是
(3)元素X和W形成的化合物的化学式为
(4)元素X和Y所形成的最高价氧化物所对应的水化物酸性强弱顺序为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:这几种元素都是短周期元素,根据元素在周期表位置知,Z属于第三周期元素,Z元素原子核外电子总数是其最外层电子数的3倍,设其最外层电子数是x,其电子总数为10+x,3x=10+x,x=5,所以Z是P,则W是S元素、X是C元素、Y是N元素,
(1)根据Y电子层数、最外层电子数确定Y在周期表中的位置;
(2)水溶液呈碱性的氢化物是NH3,氨气分子中N原子和每个H原子之间都存在一对共用电子,N原子还存在一个孤电子对;
(3)X是C元素、W是S元素,二者形成化合物二硫化碳;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强.
(1)根据Y电子层数、最外层电子数确定Y在周期表中的位置;
(2)水溶液呈碱性的氢化物是NH3,氨气分子中N原子和每个H原子之间都存在一对共用电子,N原子还存在一个孤电子对;
(3)X是C元素、W是S元素,二者形成化合物二硫化碳;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:这几种元素都是短周期元素,根据元素在周期表位置知,Z属于第三周期元素,Z元素原子核外电子总数是其最外层电子数的3倍,设其最外层电子数是x,其电子总数为10+x,3x=10+x,x=5,所以Z是P,则W是S元素、X是C元素、Y是N元素,
(1)Y是N元素,N原子核外有2个电子层、最外层有5个电子,所以N元素位于第二周期第VA族,故答案为:2;VA;
(2)水溶液呈碱性的氢化物是NH3,氨气分子中N原子和每个H原子之间都存在一对共用电子,N原子还存在一个孤电子对,氨气分子电子式为 ,
,
故答案为: ;
;
(3)X是C元素、W是S元素,二者形成化合物二硫化碳,化学式为CS2,故答案为:CS2;
(4)元素的非金属性N>C,所以最高价含氧酸酸性HNO3>H2CO3,故答案为:HNO3>H2CO3.
(1)Y是N元素,N原子核外有2个电子层、最外层有5个电子,所以N元素位于第二周期第VA族,故答案为:2;VA;
(2)水溶液呈碱性的氢化物是NH3,氨气分子中N原子和每个H原子之间都存在一对共用电子,N原子还存在一个孤电子对,氨气分子电子式为
 ,
,故答案为:
 ;
;(3)X是C元素、W是S元素,二者形成化合物二硫化碳,化学式为CS2,故答案为:CS2;
(4)元素的非金属性N>C,所以最高价含氧酸酸性HNO3>H2CO3,故答案为:HNO3>H2CO3.
点评:本题考查了元素周期表和元素周期律综合应用,根据原子结构、元素周期表结构确定元素,再结合物质结构、元素周期律分析解答,会根据原子结构确定元素在周期表中的位置,题目难度不大.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、16g O2中含有的氧原子数为NA |
| B、只有在标准状况下,NA个H2的体积才是22.4L |
| C、1mol Fe与足量Cl2反应转移的电子数为2NA |
| D、1mol?L-1 CuSO4溶液中含有的Cu2+数目为NA |
将n mol的Cu2S与足量稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的HNO3中被还原的HNO3的物质的量是( )
| A、4n mol | ||
| B、10n mol | ||
C、
| ||
D、
|
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| D、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |


