题目内容
16.Na、Cu、O、Si、S、Cl是常见的六种元素.(1)S的基态原子核外有2个未成对电子;Cu的基态核外电子排布式为1s22s22p63s23p63d104s1.
(2)选填“>”或“<”:
| 离子半径 | 酸性 |
| Na+< O2- | H2SO4<HClO4 |
分析 (1)S原子核外电子排布式为1s22s22p63s23p4,3p能级中有2个未成对电子;Cu原子核外电子数为29,根据能量最低原理书写核外电子排布式;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;
非金属性越强,最高价含氧酸的酸性越强;
(3)发生反应:4CuCl+O2=2CuO+2CuCl2,计算4molCuCl反应放出的热量,注明物质聚集状态与反应热书写热化学方程式.
解答 解:(1)S原子核外电子排布式为1s22s22p63s23p4,3p能级中有2个未成对电子;Cu原子核外电子数为29,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:2;1s22s22p63s23p63d104s1;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Na+<O2-;
非金属性S<Cl非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SO4<HClO4,
故答案为:<;<;
(3)发生反应:4CuCl+O2=2CuO+2CuCl2,4molCuCl反应放出的热量为44.4kJ×4=177.6kJ,反应热化学方程式为:4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuO(s)+2CuCl2(s)△H=-177.6kJ/mol.
点评 本题考查核外电子排布、微粒半径比较、元素周期律应用、热化学方程式书写,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
7.下列关于溶液和胶体的叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 胶体粒子可以通过半透膜而溶液不行,故可以用半透膜来分离胶体和溶液 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
4.下列物质的溶液中分别滴加Ba(OH)2溶液至过量,反应产生的沉淀的质量(m)或物质的量(n)随加入的Ba(OH)2溶液体积关系图象正确的是( )
| A. | 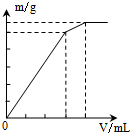 Al2(SO4)2 | B. | 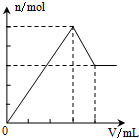 KAl(SO4)2 | C. | 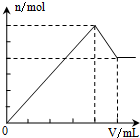 NH4Al(SO4)2 | D. | 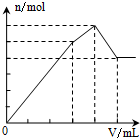 NH4Al(SO4)2 |
11.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用工业污水直接灌溉农田 | ||
| C. | 用O3替代Cl2作饮用水消毒剂 | D. | 含Hg2+的废水直接排放 |
1.已知:Na2SO3+H2O+I2=Na2SO4+2HI.现有一无色溶液,可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
①肯定不含Cu2+;②肯定不含I-;③肯定含有SO32-;④可能含有I-.
| A. | ①③ | B. | ①③④ | C. | ①② | D. | ②③④ |
10.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
 图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:
图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察: