题目内容
1.下列反应中,不能形成原电池反应的是( )| A. | 氢氧化钠与盐酸反应 | B. | 金属锌与稀硫酸反应 | ||
| C. | 甲烷燃烧 | D. | 金属铜溶于氯化铁溶液 |
分析 构成原电池的反应为自发的进行氧化还原反应,氧化还原反应中存在元素化合价的变化,据此分析.
解答 解:A.氢氧化钠与盐酸反应不存在化合价的变化,属于非氧化还原反应,不能形成原电池反应,故A选;
B.金属锌与稀硫酸反应,Zn、H元素的化合价发生变化,属于氧化还原反应,能形成原电池反应,故B不选;
C,甲烷燃烧,C、O元素的化合价发生变化,属于氧化还原反应,能形成原电池反应,故C不选;
D.金属铜溶于氯化铁溶液,Cu、Fe元素的化合价发生变化,属于氧化还原反应,能形成原电池反应,故D不选;
故选A.
点评 本题考查了原电池的构成和氧化还原反应,注意把握氧化还原反应的判断方法,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
7.下列关于溶液和胶体的叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 胶体粒子可以通过半透膜而溶液不行,故可以用半透膜来分离胶体和溶液 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
16.从下列事实所列出的相应结论合理的是( )
| A. | SO2的水溶液可以导电说明是SO2电解质 | |
| B. | 加热NaOH溶液时不能使用玻璃试管,因为玻璃中的SiO2能与NaOH反应 | |
| C. | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH4+ | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-或HCO3- |
6.某原电池结构如图所示,下列有关该原电池的说法正确的是( )
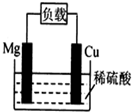

| A. | 电池反应为:Mg+2H+=Mg2++H2↑ | B. | 镁棒发生还原反应 | ||
| C. | 电子从铜棒经外电路流向镁棒 | D. | 铜棒为负极 |
13.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
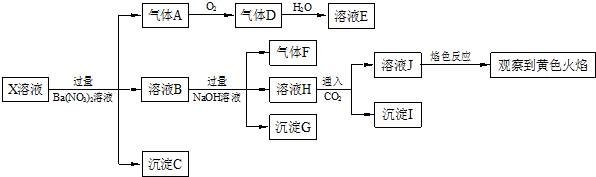
下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是 A13+、Na+、K+和C1- |
10.下列说法正确的是( )
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
11.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
 图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:
图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察: