题目内容
17.下列判断不正确的是( )| A. | 气态氢化物的热稳定性:H20>NH3 | |
| B. | 最高价氧化物对应水化物的酸性:H3PO4<H2SO4 | |
| C. | 原子半径:Na>Mg>Al | |
| D. | N元素的最高价氧化物对应的水化物和它的氢化物反应不能生成盐 |
分析 A.元素非金属性越强,氢化物越稳定;
B.非金属性越强,最高价氧化物对应的水化物酸性越强;
C.同周期自左到右原子半径逐渐减小;
D.N元素的最高价氧化物对应的水化物是硝酸,它的氢化物是氨气.
解答 解:A.因非金属性O>N,所以气态氢化物的热稳定性:H20>NH3,故A正确;
B.因非金属性S>P,所以最高价氧化物对应水化物的酸性:H3PO4<H2SO4,故B正确;
C.因为同周期自左到右原子半径逐渐减小,所以原子半径:Na>Mg>Al,故C正确;
D.N元素的最高价氧化物对应的水化物是硝酸,它的氢化物是氨气,二者反应生成硝酸铵,故D错误;
故选D.
点评 本题考查元素周期律的递变规律,题目难度不大,掌握原子半径、金属性和非金属性的判断依据是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列用以表示原电池或电解池中物质变化的化学用语中,不正确的是( )
| A. | 钢铁发生电化学腐蚀的负极反应式是Fe-2e-═Fe2+ | |
| B. | 甲醇燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 分别用铁棒作阳极、碳棒作阴极电解氯化铜溶液的离子方程式为:2Cl-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu↑+Cl2↑ | |
| D. | 电解熔融氯化镁时,阳极的电极反应式为2Cl--2e-═Cl2↑;阴极的电极反应式为Mg2++2e-═Mg |
8.下列叙述中错误的是( )
| A. | 乙烯和苯使溴水褪色的原理不同 | |
| B. | 乙烯和聚乙烯中都有碳碳双键 | |
| C. | 煤的气化和液化都是化学变化 | |
| D. | 甲烷中混有乙烯时,仅用酸性KMnO4溶液不能提纯 |
12.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:
请回答下列问题:
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
2.为了加快锌与稀硫酸的反应制氢气的速率,下列方法错误的是( )
| A. | 适当提高硫酸浓度 | B. | 将锌粒变小 | ||
| C. | 将硫酸改为浓硫酸 | D. | 适当升高温度 |
9.某有机物A在酸性溶液中加热可发生如下反应,下列说法错误的是( )
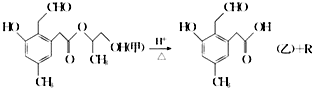

| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
6.科学家预测原子序数为114的元素,具有相当稳定性的同位素,称为类铅.关于它的性质,预测错误的是( )
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它的最高价氧化物的水化物是强酸 | D. | 它的位置在第7周期IVA族 |
7.下列关于能量转换的认识不正确的是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
 .
.