题目内容
5.用化学知识解答(1)氢氧根离子(OHˉ)的电子式
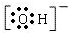 .
.(2)标准状况下,22.4L C2H2气体完全燃烧生成二氧化碳气体和液态水,放出1299.4kJ的热量,反应的热化学方程式2C2H2(g)+3O2(g)═4CO2(g)+2H2O(l)△H=-2598.8 kJ•molˉ1.
(3)在Mg(OH)2沉淀中加入CH3COONH4溶液,白色沉淀会溶解,写出反应的离子方程式Mg(OH)2+2NH4+═Mg2++2NH3•H2O.
(4)配平氧化还原反应的离子方程式:
5Mn2++2ClO3-+4H2O═5MnO2↓+1Cl2↑+8H+.
分析 (1)氢氧根离子为阴离子,电子式中需要标出原子的最外层电子及带有的电荷;
(2)C2H2 22.4L即1mol在空气中完全燃烧,生成CO2气和液态水,放出1299.4kJ热量,所以可以计算2mol乙炔燃烧会放出的热量;
(3)CH3COONH4水解导致溶液呈酸性,酸能和碱反应生成盐和水;
(4)依据得失电子守恒判断即可.
解答 解:(1)氢氧根离子为阴离子,电子式中需要标出电荷及原子的最外层电子,氢氧根离子的电子式为: ,故答案为:
,故答案为: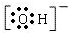 ;
;
(2)1mol乙炔完全燃烧放出热量为1299.4kJ,故2C2H2(g)+3O2(g)═4CO2(g)+2H2O(l)△H=-2598.8 kJ•molˉ1,故答案为:2C2H2(g)+3O2(g)═4CO2(g)+2H2O(l)△H=-2598.8 kJ•molˉ1;
(3)CH3COONH4水解导致溶液呈酸性,酸和碱反应生成盐和水,离子反应方程式为:Mg(OH)2+2NH4+═Mg2++2NH3•H2O,故答案为:Mg(OH)2+2NH4+═Mg2++2NH3•H2O;
(4)该反应中Mn由+2价升高到+4价,Cl 由+5价降低到0价,且生成氯气,总共得电子数是10,故Mn前系数为5,氯酸根为2,然后依据电子守恒和原子守恒得知,缺少的一项为氢离子,故答案为:5 2 4 5 1 8 H+.
点评 本题主要考查的是氧化还原反应的配平、燃烧反应方程式的书写、电子式的书写等,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
15.下列说法不正确的是( )
| A. | CH3CH=CH2和CH2=CH2的最简式相同 | |
| B. | 二氯甲烷没有同分异构体 | |
| C. | 丁二烯和丁烯为同系物 | |
| D. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 |
16.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1L0.1mol/L HCl溶液中含有0.1NA个HCl分子 | |
| B. | 23gNa在空气中燃烧生成Na2O2时转移电子数目为2NA | |
| C. | 28gCO和N2的混合气体中电子数目为14NA | |
| D. | 11.2LCO2含氧原子数为NA |
13.天然气的主要成分是甲烷,液化气的主要成分是丁烷,欲将烧液化气的灶具改烧天然气,使燃料充分燃烧且灶具温度最高,下列操作正确的是( )
| A. | 减少进气量,增大进风量 | B. | 减少进气量,减少进风量 | ||
| C. | 不作任何改变 | D. | 增大进气量,减少进风量 |
10.同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性是:H3XO4<H2YO4<HZO4,则下列判断正确的是( )
| A. | 非金属性强弱:X>Y>Z | B. | 原子序数大小:X<Y<Z | ||
| C. | 原子半径大小:X<Y<Z | D. | 原子最外层电子数:X>Y>Z |
17.下列判断不正确的是( )
| A. | 气态氢化物的热稳定性:H20>NH3 | |
| B. | 最高价氧化物对应水化物的酸性:H3PO4<H2SO4 | |
| C. | 原子半径:Na>Mg>Al | |
| D. | N元素的最高价氧化物对应的水化物和它的氢化物反应不能生成盐 |
14.下列说法中不正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键叫离子键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
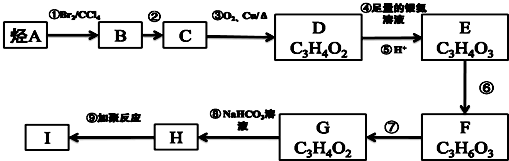
 .
.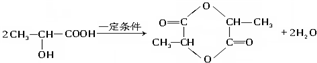 .
.