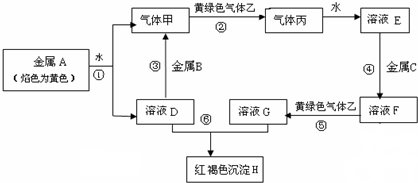
题目内容
9.某有机物A在酸性溶液中加热可发生如下反应,下列说法错误的是( )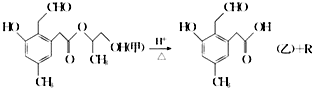
| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
分析 A.甲在酸性条件下发生水解反应生成乙和乙二醇,醛能发生银镜反应;
B.醛基和苯环能和氢气在一定条件下发生加成反应;
C.甲中含有酯基,在碱性条件下也能发生水解反应;
D.含有醛基的物质能发生银镜反应.
解答 解:A.甲在酸性条件下发生水解反应生成乙和乙二醇,醛能发生银镜反应,乙二醇中不含醛基,则不能发生银镜反应,故A正确;
B.醛基和苯环能和氢气在一定条件下发生加成反应,所以1 mol甲在一定条件下与氢气反应,最多可消耗 4mol H2,故B错误;
C.甲中含有酯基,在碱性条件下也能发生水解反应,在酸性条件下也能发生水解反应,故C正确;
D.含有醛基的物质能发生银镜反应,甲、乙都含醛基,则都能发生银镜反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯、醛和苯的性质,注意该酯羧基产物成分,题目难度不大.

练习册系列答案
相关题目
19.下列过程需要吸收热量的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条和盐酸反应 | D. | 氢氧化钠与盐酸反应 |
17.下列判断不正确的是( )
| A. | 气态氢化物的热稳定性:H20>NH3 | |
| B. | 最高价氧化物对应水化物的酸性:H3PO4<H2SO4 | |
| C. | 原子半径:Na>Mg>Al | |
| D. | N元素的最高价氧化物对应的水化物和它的氢化物反应不能生成盐 |
14.下列说法中不正确的是( )
| A. | 共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键叫离子键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
1.一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3.下列关于该反应的说法正确的是( )
| A. | 最终可生成0.2 mol NH3 | |
| B. | 增大压强能使反应速率减小 | |
| C. | 降低反应体系的温度能加快反应速率 | |
| D. | 向容器中再加入N2,能加快反应速率 |
18.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素的原子结构示意图为 .
.
(2)元素⑧的名称为氯,其最高价氧化物的水化物的化学式为HClO4.
(3)元素③与元素⑧形成的化合物的电子式为 .
.
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K(填元素符号);元素①单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是NaOH.
(6)能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ④ |
 .
.(2)元素⑧的名称为氯,其最高价氧化物的水化物的化学式为HClO4.
(3)元素③与元素⑧形成的化合物的电子式为
 .
.(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K(填元素符号);元素①单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是NaOH.
(6)能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
 .
. .
.