题目内容
17. X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的单质中,Z的熔沸点最低 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Y的气态氢化物的稳定性较Z的弱 | |
| D. | 离子半径:Z>W>X>Y |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子只能有2个电子层,最外层电子数为6,则Y为O元素,根据X、Y、Z、W在周期表中相对位置可知,X为N元素、Z为S元素、W为Cl元素,据此判断即可.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子只能有2个电子层,最外层电子数为6,则Y为O元素,根据X、Y、Z、W在周期表中相对位置可知,X为N元素、Z为S元素、W为Cl元素,
A.四元素的单质中,硫(Z)常温下为固体,其它三种为气体,故硫的熔、沸点最高,故A错误;
B.非金属性W>Z,故最高价氧化物对应水化物的酸性W>Z,故B错误;
C.非金属性Y>Z,故Y的气态氢化物的稳定性较Z的强,故C错误;
D.同周期随原子序数增大原子半径碱性,电子层越多原子半径越大,则原子半径大小为:Z>W>X>Y,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,正确推断Y元素的名称为解答关键,注意掌握元素周期律内容,理解同主族、同周期元素性质的递变规律.

练习册系列答案
相关题目
9.设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 5.6g Fe粉与足量的稀硝酸完全反应,失电子总数为0.2NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17g氨气中所含原子数为NA |
12.工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的pH到4,应加入的试剂是( )
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
2.实验室需配置一种符合下列条件的溶液:①无色且仅含四种离子(不包括水电离出的离子);②混合溶液中四种离子的物质的量浓度均为1mol/L.下列符合该条件的是( )
| A. | NH+4 Na+ NO-3 Cl- | B. | Fe2+ K+ HS- ClO- | ||
| C. | Ca2+ K+ SO32- CH3COO- | D. | K+ Na+ Cl- SO42- |
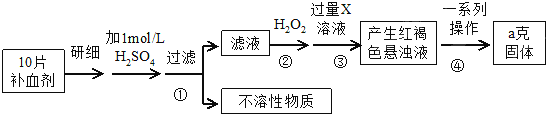


 .
. .
. .
.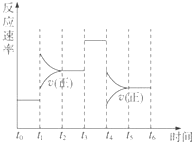 在体积固定的密闭体系中发生下列反应:
在体积固定的密闭体系中发生下列反应: