题目内容
8.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如图: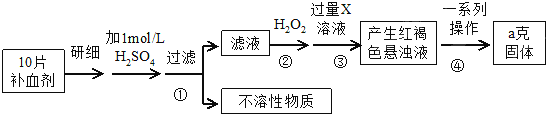
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸),该过程的现象为:溶液开始不变色,后变为血红色.
(2)步骤②加入过量H2O2的目的:将Fe2+全部氧化为Fe3+.
(3)步骤③中反应的离子方程:Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+].
(4)步骤④中一列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量0.07ag.
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需250mL容量瓶.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是b.
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为紫或紫红色.若滴定到终点时俯视滴定管刻度线,对测量值有何影响?
偏低( 填“偏高、偏低或无影响”).
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,
(1)Fe3+遇KSCN溶液显血红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+;
(3)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入的X可以是碱或氨水;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
②加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果;
③用高锰酸钾溶液滴定亚铁离子时,滴定到终点时溶液会出现紫色或紫红色,若滴定到终点时俯视滴定管刻度线,则读出的高锰酸钾溶液的体积偏小,据此判断;
解答 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-?Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,
故答案为:将Fe2+全部氧化为Fe3+;
(3)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入的X可以是氢氧化钠溶液或氨水,反应方程式为Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+],
故答案为:Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+];
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
②高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,答案为:b;
③用高锰酸钾溶液滴定亚铁离子时,滴定到终点时溶液会出现紫色或紫红色,若滴定到终点时俯视滴定管刻度线,则读出的高锰酸钾溶液的体积偏小,所以会使测量值偏低,
故答案为:紫或紫红;偏低.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 若R是硫元素、则C是Na2SO3 | B. | 若R是硅元素、则C是Na2Si03 | ||
| C. | 若R是碳元素、则C是Na2CO3 | D. | 若R是氯元素、则C是NaCl |
| A. | 化学反应速率可用某时刻生成物的物质的量浓度的增加来表示 | |
| B. | 在同一反应中,用各种物质表示的化学反应速率的大小相等 | |
| C. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| D. | 若反应现象在短时间内出现,则反应速率快,反应现象若不出现,则该反应速率一定慢 |
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 醋酸与NaOH的反应:H++OH-═H2O | |
| D. | 碳酸镁与稀硫酸:MgCO3+2H+═Mg2++H2O+CO2↑ |
| A. | 常温常压下,22.4L N2含有的分子数为NA | |
| B. | 1mol•L-1 Al2(SO4)3溶液中含SO42-数目为3NA | |
| C. | 常温常压下,46g NO2含有氧原子数为2NA | |
| D. | 1mol Fe在足量Cl2中燃烧,转移电子数为2NA |
| A. | 焰色反应 | B. | 碘升华 | C. | 液溴挥发 | D. | 铁生锈 |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的单质中,Z的熔沸点最低 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Y的气态氢化物的稳定性较Z的弱 | |
| D. | 离子半径:Z>W>X>Y |
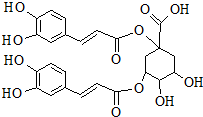 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )| A. | 1mol洋蓟素最多可与6molBr2反应 | |
| B. | 1mol洋蓟素最多可与7molNa2CO3反应 | |
| C. | 一定条件下能发生酯化反应和消去反应 | |
| D. | 1mol洋蓟素最多可与9molNaOH反应 |