题目内容
11.某烃的密度是氢气密度的14倍,分子中碳与氢的质量比为6:1,写出分子式C2H4.分析 结合相对密度计算M,由分子中碳与氢的质量比为6:1计算出C、H原子个数比,以此得到化学式.
解答 解:烃的密度是氢气密度的14倍,M=2L/mol×14g/L=28g/mol,
分子中碳与氢的质量比为6:1,
则C、H原子个数比为$\frac{6}{12}$:1=1:2,
设烃分子式为CnH2n,则12×n+1×2n=28,解得n=2,
即该烃的分子式为C2H4,
故答案为:C2H4.
点评 本题考查有机物分子式确定的计算,为高频考点,把握物质的量的相关计算公式、分子式中原子个数比的计算方法等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.下列关于化学素养的说法中,正确的是( )
| A. | 海水中含有丰富的碘元素,故碘被称为“海洋元素” | |
| B. | 溴化银是一种重要的感光材料,也可用于人工降雨 | |
| C. | 钠在盛有氯气的集气瓶中燃烧,火焰呈苍白色,产物为NaCl;铁在盛有氯气的集气瓶中燃烧,火焰呈棕黄色,产物为FeCl3 | |
| D. | 工业炼铁的设备是炼铁高炉,过程中加入石灰石的作用是除脉石(SiO2)造渣 |
2.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 新制的含NA个Fe(OH)3分子的氢氧化铁胶体中,含有胶粒的物质的量为1mol | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
19.反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1=akJ•mol-1,平衡常数为K;反应②CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H2=bkJ•mol-1.测得在不同温度下,K值如表:
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO的平衡浓度为1mol/L.
(2)反应①中的a大于 0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积 B.通入CO2 C.升高温度到 900℃D.使用合适的催化剂
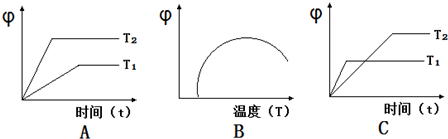
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).
(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3=2(a+b)kJ•mol-1.
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)反应①中的a大于 0(填“大于”、“小于”或“等于”).
(3)700℃时反应①达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有(填序号).
A.缩小反应器体积 B.通入CO2 C.升高温度到 900℃D.使用合适的催化剂
(4)如图图象符合反应①的是(填序号)(图中φ是混合物中CO的含量;T为温度).

(5)反应③2Fe(s)+O2(g)═2FeO(s)△H3=2(a+b)kJ•mol-1.
16.已知三氧化硫的熔点为16.8℃,沸点为44℃,下列有关三氧化硫的说法中,正确的是( )
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
3.下列物质不属于醇类的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下列离子方程式中,正确的是( )
| A. | 饱和NaHCO3溶液中通入过量CO2:CO32-+CO2+H2O═HCO3- | |
| B. | 金属铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO32-═CaCO3↓ | |
| D. | 氯化铝与过量氨水反应:Al3++4OH-═AlO2-+2H2O |