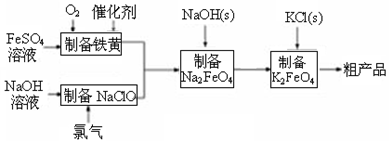
题目内容
18.25℃时,在25.00mL 0.1000mol•L-1CH3COOH中滴入0.1000mol•L-1的氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积关系如图所示.已知0.1000mol•L-1CH3COOH的电离度为1.33%,下列有关叙述正确的是( )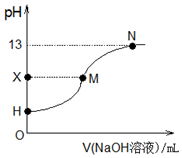
| A. | 酸碱滴定选用指示剂:甲基橙试液 | |
| B. | H点处的溶液:pH<3 | |
| C. | X=7时,M点对应加入氢氧化钠溶液的体积:25.00 mL | |
| D. | H、M、N三点各自对应的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.弱酸和强碱溶液滴定选取酚酞作指示剂,强酸和弱碱溶液滴定时选取甲基橙作指示剂;
B.H点溶液中c(H+)=c(CH3COOH)×1.33%;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,常温下pH>7,如果X=7,则溶液中的溶质为醋酸和醋酸钠;
D.H点溶液中溶质为醋酸,没有醋酸钠.
解答 解:A.弱酸和强碱溶液滴定选取酚酞作指示剂,强酸和弱碱溶液滴定时选取甲基橙作指示剂,醋酸是弱酸、NaOH是强碱,所以该酸碱滴定应该选取酚酞作指示剂,故A错误;
B.H点溶液中c(H+)=c(CH3COOH)×1.33%=0.1000mol/L×1.33%=1.33×10-3 mol/L,pH<3,故B正确;
C.醋酸钠是强碱弱酸盐,其水溶液呈碱性,常温下pH>7,如果X=7,则溶液中的溶质为醋酸和醋酸钠,所以M点对应加入氢氧化钠溶液的体积小于25.00 mL,故C错误;
D.H点溶液中溶质为醋酸,没有醋酸钠,所以H点存在c(H+)=c(CH3COO-)+c(OH-),故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析、判断、计算能力,明确酸碱指示剂的选取方法、溶液中的溶质成分及其性质等知识点是解本题关键,注意H点不存在钠离子,为易错点.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
9.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+20H-═CaCO3↓+CO32-+H2O | |
| B. | 碘水中通入足量的 S02:I2+SO2+2H2O═2I-+S042-+4H+ | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4:3ClO+2Fe(OH)3═2FeO32-+3Cl-+H2O+4H+ |
3.关于化学能与热能的叙述,正确的是( )
| A. | 需要加热才能发生的反应,一定是吸热反应 | |
| B. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| C. | 化学反应中的能量变化都表现为热量的变化 | |
| D. | 化学反应中的能量变化,主要是由化学键的变化引起的 |

 (6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气
(6)氯仿 (7)三氯甲烷(8)臭氧(9)氧气