题目内容
9.下列表示对应化学反应的离子方程式正确的是( )| A. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+20H-═CaCO3↓+CO32-+H2O | |
| B. | 碘水中通入足量的 S02:I2+SO2+2H2O═2I-+S042-+4H+ | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4:3ClO+2Fe(OH)3═2FeO32-+3Cl-+H2O+4H+ |
分析 A.氢氧化钠少量,所有的碳酸根离子都转化成碳酸钙沉淀;
B.碘单质能够将二氧化硫氧化成硫酸;
C.一水合氨为弱碱,二者反应生成氢氧化铝沉淀;
D.强碱性溶液中,反应产物中不会生成氢离子.
解答 解:A.向碳酸氢钙溶液中加入少量烧碱溶液,二者反应生成碳酸钙沉淀、碳酸氢钠和水,正确的离子方程式为:Ca2++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.碘水中通入足量的 SO2,二者发生氧化还原反应生成硫酸和HI,反应的离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+,故B正确;
C.向氯化铝溶液中滴加过量氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,正确的离子方程式为:4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
7.马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图:
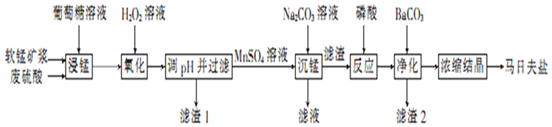
(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
(4)加入磷酸后发生反应的化学方程式为MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O.
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.

(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.
14.(1)某有机物的键线式如图 ,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
(2)蒸馏含有杂质的工业乙醇,使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶.
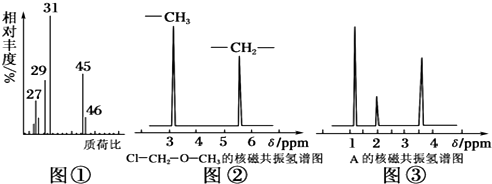
(3)为研究某有机物A的组成于结构,进行了如下实验:
(4)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题.甲醇甲醇(CH3OH)燃料电池结构如图所示,外电路中电子从A到B(填“A”或“B”)移动,写出电池负极的电极反应式CH3OH-6e-+H2O=CO2+6H+

 ,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.
,其分子式为C6H14,名称是2-甲基戊烷,它可由2种炔通过加成反应得到.(2)蒸馏含有杂质的工业乙醇,使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、尾接管、锥形瓶.
(3)为研究某有机物A的组成于结构,进行了如下实验:
| 实验步骤 | 解 释 或 实 验 结 论 |
| (1)称取A 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①A的相对分子质量为90. |
(2)A的核磁共振氢谱如图: | ②A中含有4种氢原子. |

1.化学与社会生活紧密相关,下列说法不正确的是( )
| A. | 大量塑料废弃物会造成严重的白色污染,应将其焚烧处理 | |
| B. | 应用放射性同位素发射出的射线,可进行食物保鲜和肿瘤治疗 | |
| C. | 过度开采使用煤、石油等化石燃料,会导致空气中PM2.5浓度升高 | |
| D. | 近两年全国普遍取消了各种节日焰火晚会,对减缓空气污染起到了一定作用 |
18.25℃时,在25.00mL 0.1000mol•L-1CH3COOH中滴入0.1000mol•L-1的氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积关系如图所示.已知0.1000mol•L-1CH3COOH的电离度为1.33%,下列有关叙述正确的是( )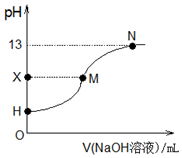

| A. | 酸碱滴定选用指示剂:甲基橙试液 | |
| B. | H点处的溶液:pH<3 | |
| C. | X=7时,M点对应加入氢氧化钠溶液的体积:25.00 mL | |
| D. | H、M、N三点各自对应的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
19.短周期元素a、b,c、d、e在周期表中的位置如图,下列说法正确的是( )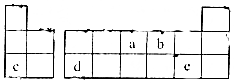

| A. | 气态氢化物的稳定性:a>b>c | |
| B. | 原子半径大小:a>b>c | |
| C. | c,d,e的氧化物对应的水化物之间两两皆能反应 | |
| D. | b、c形成的化合物中阴、阳离子的个数比为1:2 |
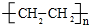 .
. .
. .M的核磁共振氢谱图中有4组吸收峰.
.M的核磁共振氢谱图中有4组吸收峰.