题目内容
VmL硫酸铁溶液中含a g Fe3+,从该溶液中取出
mL,并稀释至2VmL,则稀释后溶液中的SO42-物质的量浓度约为( )
| V |
| 2 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算a g Fe3+的物质的量,VmL溶液中n(SO42-)=
n(Fe3+),根据c=
计算VmL溶液中c(SO42-),在根据稀释定律计算稀释后溶液中SO42-的物质的量浓度.
| m |
| M |
| 3 |
| 2 |
| n |
| V |
解答:
解:a g Fe3+的物质的量=
=
mol,VmL溶液中n(SO42-)=
n(Fe3+)=
×
mol,根据c=
计算VmL溶液中c(SO42-)=
=
mol/L,令稀释后溶液中SO42-的物质的量浓度为c,根据稀释定律:
mol/L×
×10-3L=c×2V×10-3L,解得c=
mol/L,故选C.
| ag |
| 56g/mol |
| a |
| 56 |
| 3 |
| 2 |
| 3 |
| 2 |
| a |
| 56 |
| n |
| V |
| ||||
| V×10-3L |
| 375a |
| 14V |
| 375a |
| 14V |
| V |
| 2 |
| 375a |
| 56V |
点评:本题考查物质的量浓度计算,注意对公式的理解与灵活应用,侧重对基础知识的巩固,难度不大.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=12的溶液中:K+、Na+、Br-、SiO32- | ||
| B、c(Fe3+)=0.1mol?L-1的溶液中:K+、ClO-、SO42-、SCN- | ||
C、
| ||
| D、无色溶液中:K+、Fe2+、NO3-、SO42- |
化学与生活、生产密切相关,下列说法正确的是( )
| A、食盐、食醋、食用油均可用作食品添加剂,都属于有机物 |
| B、碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 |
| C、工业生产玻璃和水泥,均需要用石灰石为原料 |
| D、海水淡化是解决淡水供应危机的方法之一,向海水中加入明矾可以使海水淡化 |
能正确表示下列反应的离子方程式是( )
| A、少量的CO2通人氨水中:CO2+NH3?H2O═NH4++HCO3- | ||||
| B、Na2O2溶于水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | ||||
| C、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3+ | ||||
D、用惰性电极电解熔融氯化钠:2Cl-+2H2O
|
有X、Y、Z、W、M五种原子序数依次增大的短周期主族元素,其中X元素的气态氢化物水溶液显碱性,离子半径Y2->W3+,Y、Z元素的最外层电子数之和等于M元素的最外层电子数.下列说法正确的是( )
| A、X、Y形成的气态氢化物的沸点前者高 |
| B、W、M形成的化合物可作为水处理中的消毒剂 |
| C、工业上通常用电解法制备Z、W、M的单质 |
| D、X、Z形成的化合物ZX3和Z3X所含键的类型相同 |
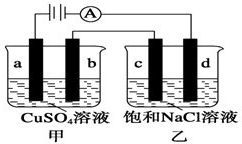 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
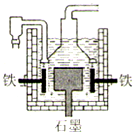 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:Ⅰ:4NaOH(熔融)
| ||
Ⅱ:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑
Ⅲ:3NaCl(熔融)
| ||
下列有关说法正确的是( )
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |