题目内容
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物B可用于制造高性能的现代通讯材料--光导纤维,B与烧碱反应生成含A元素的化合物D.
(1)易与B发生化学反应的酸是 (填化学名称),该化学反应的重要应用是 .
(2)将B与纯碱混合,高温熔融时也发生化学反应生成D,同时还生成氧化物C;
①写出生成D和C的化学反应方程式: .
②要将纯碱高温熔化,下列坩埚中不 可选用的是 .
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
③将过量的C通入D的溶液中发生反应的化学方程式是: .
(3)B与石灰石、B与纯碱发生相似的化学反应.100g B与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是 .
(4)A的单质与烧碱溶液和铝的单质与烧碱溶液发生相似的化学反应.相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为 .
(1)易与B发生化学反应的酸是
(2)将B与纯碱混合,高温熔融时也发生化学反应生成D,同时还生成氧化物C;
①写出生成D和C的化学反应方程式:
②要将纯碱高温熔化,下列坩埚中不
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
③将过量的C通入D的溶液中发生反应的化学方程式是:
(3)B与石灰石、B与纯碱发生相似的化学反应.100g B与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是
(4)A的单质与烧碱溶液和铝的单质与烧碱溶液发生相似的化学反应.相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为
考点:硅和二氧化硅
专题:碳族元素
分析:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物B可用于制造高性能的现代通讯材料--光导纤维,则B为SiO2,B与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)氢氟酸能与二氧化硅反应与生成四氟化硅气体;
(2)①SiO2与Na2CO3反应生成的Na2SiO3与CO2;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应;
③过量CO2通入Na2SiO3溶液中生成的物质是NaHCO3而不是Na2CO3;
(3)根据n(CaCO3)=n(CO2)解题;
(4)根据反应方程式计算.
(1)氢氟酸能与二氧化硅反应与生成四氟化硅气体;
(2)①SiO2与Na2CO3反应生成的Na2SiO3与CO2;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应;
③过量CO2通入Na2SiO3溶液中生成的物质是NaHCO3而不是Na2CO3;
(3)根据n(CaCO3)=n(CO2)解题;
(4)根据反应方程式计算.
解答:
解:(1)氢氟酸能与二氧化硅反应与生成四氟化硅气体,用氢氟酸作玻璃的刻蚀剂和不能使用玻璃容器盛装氢氟酸,都属于SiO2+4HF═SiF4↑+2H2O的重要应用,故答案为:氢氟酸;用氢氟酸作玻璃的刻蚀剂;
(2)①SiO2与Na2CO3反应生成的Na2SiO3与CO2的物质的量之比是1:1,化学方程式:SiO2+Na2CO3
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑;
②SiO2与纯碱在高温下反应生成硅酸钠和二氧化碳,原因是难挥发性酸酐制取挥发性酸酐,由于碳酸酸性比硅酸强,则二氧化碳通入硅酸钠溶液中生成硅酸沉淀和碳酸钠,由于普通玻璃坩埚、石英玻璃坩埚、氧化铝坩埚等在高温下都能与碳酸钠反应而使坩埚炸裂,则应用铁坩埚,故答案为:ABC;
③过量CO2通入Na2SiO3溶液中生成的物质是NaHCO3而不是Na2CO3,反应的化学方程式是:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3,
故答案为:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3;
(3)首先要仿照Na2CO3与SiO2的化学反应确定CaCO3与SiO2的化学反应,然后要找出CaCO3+SiO2
CaSiO3+CO2↑和CaCO3
CaO+CO2↑两个化学反应中n(CaCO3)与n(CO2)的关系:n(CaCO3)=n(CO2).
生成标准状况下CO2气体11.2L,其物质的量=
=0.5mol,
m(CaCO3)=0.5mol×100g/mol=50g
样品中碳酸钙的质量分数:
×100%=50%
故答案为:50%;
(4)根据Si+2NaOH+H2O═Na2SiO3+2H2↑和2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为4:3,故答案为:4:3.
(2)①SiO2与Na2CO3反应生成的Na2SiO3与CO2的物质的量之比是1:1,化学方程式:SiO2+Na2CO3
| ||
故答案为:SiO2+Na2CO3
| ||
②SiO2与纯碱在高温下反应生成硅酸钠和二氧化碳,原因是难挥发性酸酐制取挥发性酸酐,由于碳酸酸性比硅酸强,则二氧化碳通入硅酸钠溶液中生成硅酸沉淀和碳酸钠,由于普通玻璃坩埚、石英玻璃坩埚、氧化铝坩埚等在高温下都能与碳酸钠反应而使坩埚炸裂,则应用铁坩埚,故答案为:ABC;
③过量CO2通入Na2SiO3溶液中生成的物质是NaHCO3而不是Na2CO3,反应的化学方程式是:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3,
故答案为:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3;
(3)首先要仿照Na2CO3与SiO2的化学反应确定CaCO3与SiO2的化学反应,然后要找出CaCO3+SiO2
| ||
| ||
生成标准状况下CO2气体11.2L,其物质的量=
| 11.2L |
| 22.4L/mol |
m(CaCO3)=0.5mol×100g/mol=50g
样品中碳酸钙的质量分数:
| 50g |
| 100g |
故答案为:50%;
(4)根据Si+2NaOH+H2O═Na2SiO3+2H2↑和2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为4:3,故答案为:4:3.
点评:本题考查无机物推断、元素化合物性质、根据方程式进行的计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
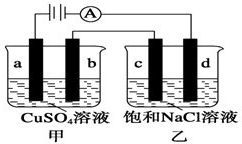 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
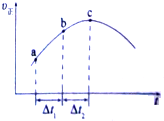 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |
在下列变化过程中,只发生物理变化的是( )
| A、浓硝酸显黄色 |
| B、雷雨发庄稼 |
| C、空气液化制取氮气 |
| D、生石灰遇水成为熟石灰 |
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容: