题目内容
15.今年入春以来,韩店雾霾天气频繁出现,空气质量很差,严重影响老百姓的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
分析 (1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;
(2)①利用盖斯定律计算反应热;
②二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;依据化学反应速率和平衡移动原理分析判断;
②根据生成物为氮气和二氧化碳书写.
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性,试样的pH值根据溶液中电荷守恒计算氢离子浓度为10-4mol/L,PH=-lgc(H+)=-lg10-4=4,
故答案为:酸性;4;
(2)①已知:①H2 (g)+$\frac{1}{2}$O2 (g)=H2O(g)△H=-241.8kJ•mol-1,
②C (s)+$\frac{1}{2}$O2 (g)=CO (g)△H=-110.5kJ•mol-1,
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.5kJ•mol-1)-(-241.8kJ•mol-1)=+13l.3 kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3 kJ•mol-1;
②洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3,故答案为:ab;
(3)①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,得K=$\frac{{c}^{2}(NO)}{c({N}_{2})•c({O}_{2})}$=$\frac{(8×1{0}^{-4})^{2}}{(0.8-4×1{0}^{-4})×(0.2-4×1{0}^{-4})}$=4×10-6,
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②在汽车尾气系统中安装催化转化器可减少CO和NO的污染,是因为生成了无污染的二氧化碳和氮气,汽车尾气系统中装置反应的化学方程式为2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$ 2CO2+N2,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题综合考查化学反应原理的基础知识,涉及pH值的计算、盖斯定律的应用、化学平衡常数的计算等,题目难度中等,注意相关知识的积累.

| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
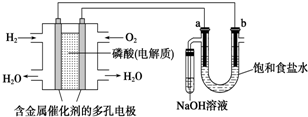
| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 忽略能量损耗,当电池中消耗0.1g H2时,b极周围会产生1.12L H2 | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 电解时,a 电极周围首先放电的是Cl- |
| A. | 甲基的电子式: | B. | 2-丁烯的键线式: | ||
| C. | 丙烯的结构简式:CH2CHCH3 | D. | 乙醇的结构式: |
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为2NA | |
| C. | 常温常压下,15g乙烷分子数目为 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
| A. | Ba(OH)2•8H2O晶体与氯化铵固体的反应 | |
| B. | 氢氧化钠溶液与盐酸反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | 高温煅烧石灰石 |
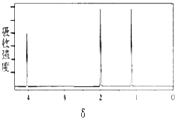
| A. | CH3-CH2-CH3 | B. | CH3CH2 CH2Br | C. | 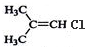 | D. | 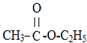 |
| A. | 溴离子具有氧化性 | B. | 溴单质是氧化剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯元素的非金属性比溴元素强 |
| A. | 质子数为1.8NA | B. | 分子数为0.1NA | C. | 中子数为2NA | D. | 原子数为2.5NA |