题目内容
下列有关阿伏加德罗常数说法正确的组合是( )
①标准状况下,22.4L氯气与足量的热NaOH溶液反应,转移电子数目为NA
②25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数目为0.2NA
③电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子数不一定等于2NA
④标准状况下,33.6L氟化氢含有氟原子的数目为1.5NA
⑤2.24LCO2和2.8gN2组成的混合物中质子数为2.8NA
⑥14gN60(分子空间结构类似C60)中含有的N-N键数目为1.5NA.
①标准状况下,22.4L氯气与足量的热NaOH溶液反应,转移电子数目为NA
②25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数目为0.2NA
③电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子数不一定等于2NA
④标准状况下,33.6L氟化氢含有氟原子的数目为1.5NA
⑤2.24LCO2和2.8gN2组成的混合物中质子数为2.8NA
⑥14gN60(分子空间结构类似C60)中含有的N-N键数目为1.5NA.
| A、③⑥ | B、①③⑥ |
| C、①③④⑥ | D、①②⑤⑥ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:①根据氯气与热碱溶液反应生成产物是氯酸根离子和氯离子进行判断;
②pH=13的氢氧化钡溶液中氢氧根离子的浓度为0.1mol/L,据此计算出氢氧根离子的物质的量;
③根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于2mol分析;
④根据氟化氢的沸点是19.54℃,标况下不是气体进行判断;
⑤根据是否是标准状况下进行分析;
⑥根据每个氮原子与其它3个氮原子结合,利用均摊法计算出含有的共价键.
②pH=13的氢氧化钡溶液中氢氧根离子的浓度为0.1mol/L,据此计算出氢氧根离子的物质的量;
③根据粗铜中含有杂质(铁)的摩尔质量比铜小,转移的电子的物质的量大于2mol分析;
④根据氟化氢的沸点是19.54℃,标况下不是气体进行判断;
⑤根据是否是标准状况下进行分析;
⑥根据每个氮原子与其它3个氮原子结合,利用均摊法计算出含有的共价键.
解答:
解:①标准状况下,22.4L氯气与足量的热碱溶液反应,氯气的物质的量是1mol,反应生成了氯离子和氯酸根离子,转移的电子物质的量为
mol,故①错误;
②pH=13的溶液中氢氧根离子的浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故②错误;
③电解精炼铜时,若阳极质量减少64g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少64g,转移的电子的物质的量大于2mol,则阴极得到的电子数大于2mol,故③正确;
④由于氟化氢的沸点是19.54℃,标况下氟化氢不是气体,无法计算33.6L氟化氢的物质的量 故④错误;
⑤2.24LCO2和2.8gN2组成的混合物中,没有告诉是标况下,无法计算二氧化碳的物质的量,也就无法计算混合气体含有的质子数,故⑤错误;
⑥14gN60(分子空间结构类似C60),含有氮原子的物质的量为1mol,每个氮原子与其它三个氮原子形成3g共价键,利用均摊法知,每个氮原子原子含有
×3=
个共价键键,所以1mol氮原子含有1.5mol共价键,故⑥正确;
所以正确的为③⑥,
故选A.
| 5 |
| 3 |
②pH=13的溶液中氢氧根离子的浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故②错误;
③电解精炼铜时,若阳极质量减少64g,由于阳极有铁杂质存在,铁的摩尔质量小于铜的,所以阳极减少64g,转移的电子的物质的量大于2mol,则阴极得到的电子数大于2mol,故③正确;
④由于氟化氢的沸点是19.54℃,标况下氟化氢不是气体,无法计算33.6L氟化氢的物质的量 故④错误;
⑤2.24LCO2和2.8gN2组成的混合物中,没有告诉是标况下,无法计算二氧化碳的物质的量,也就无法计算混合气体含有的质子数,故⑤错误;
⑥14gN60(分子空间结构类似C60),含有氮原子的物质的量为1mol,每个氮原子与其它三个氮原子形成3g共价键,利用均摊法知,每个氮原子原子含有
| 1 |
| 2 |
| 3 |
| 2 |
所以正确的为③⑥,
故选A.
点评:本题考查了阿伏伽德罗常数,是历年高考倍受青睐的试题,问题解决重在审题,并且善于总结常见易错点,注意氟化氢标况下不是气体,本题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
贴有下列危险品标志的药品起火时,不能用水灭火的是( )
A、 |
B、 |
C、 |
D、 |
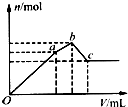 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
下列物质混合后,不能发生离子反应的是( )
| A、Na2CO3溶液与稀盐酸 |
| B、CuSO4溶液与BaCl2溶液 |
| C、稀H2SO4与NaCl溶液 |
| D、稀HNO3与Ba(OH)2溶液 |
下列物质属于非电解质的是( )
| A、醋酸 | B、氯化钠 |
| C、氢氧化钠 | D、酒精 |
用NA表示阿伏伽德罗常数.下列说法正确的是( )
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA. |
| D、常温常压下,28g氮气含有的核外电子数为10 NA |