��Ŀ����
5��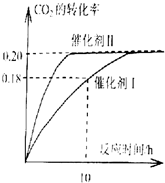 ��֪CO2����������ɫȼ�ϼ״�����Ӧ���£�
��֪CO2����������ɫȼ�ϼ״�����Ӧ���£�CO2��g��+3H2��g��?CH3OH��g��+H2O��g������H=-187.4KJ/mol��300��ʱ���ܱ������У���C��CO2��=1.00mol��L-1C��H2��=1.60mol��L-1��ʼ��Ӧ�������ͼ��ʾ���ش��������⣺
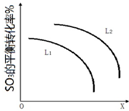
��1��ʹ�ô���Iʱ����Ӧ��10Сʱ�ڵ�ƽ����Ӧ���ʣ�V��H2��=0.054mol•��L•h��-1��
��2������������ȷ����AD��
A����������������ܶȲ��ٸı�ʱ����Ӧ��һ���ﵽƽ��״̬
B�������������ѹǿ���������{CO2��ת����
C��CO2ƽ��ת���ʣ���������Ӧ�����£�������ȴ���I��
D����Ч�ʣ���������Ӧ�����£�������ȴ������
��3�����ͼ�����ݣ�����˷�Ӧ��.300��ʱ��ƽ�ⳣ������д��������̣�
��4��������ƽ����ϵ������400�棬ƽ�ⳣ����K��400�棩�� K��300�棩�����=����
��5����֪��2H2��g��+O2��g���T2H2O��g����H=-242.8KJ/mol
��Ӧ2CH3OH��g��+3O2��g���T2CO2��g��+4H2O��g����H=-353.6kJ•mol-1��
���� ��1�����ݷ�Ӧ��10Сʱ�ڶ�����̼��ת���ʼ�������Ķ�����̼�����ʵ���Ũ�ȣ��ټ�����ö�����̼��ʾ��ƽ����Ӧ���ʣ������ݷ�Ӧ�����뻯ѧ�������Ĺ�ϵ�������������ʾ�ķ�Ӧ���ʣ�
��2��A���÷�Ӧ���߶������壬�����ݻ����䣬�����ܶ�ʼ�ղ��䣻
B������ϡ�����壬��Ӱ�췴Ӧ��ϵ�и����Ũ�ȣ���ѧƽ�ⲻ�ƶ���
C������ֻӰ�췴Ӧ���ʣ���Ӱ�컯ѧƽ�⣻
D������ͼʾ��֪���ڴ����������µķ�Ӧ���ʴ��ڱȴ����������µķ�Ӧ���ʣ�
��3������ͼ���дﵽƽ��״̬ʱ������̼��ת���ʡ����û�ѧƽ������ʽ������ﵽƽ��״̬ʱ����ֵ�Ũ�ȣ�Ȼ������ƽ�ⳣ������ʽ��������¶��µ�ƽ�ⳣ����
��4���÷�ӦΪ���ȷ�Ӧ���¶����ߣ���ѧƽ�����������ƶ�����ѧƽ�ⳣ����С��
��5�����������Ȼ�ѧ����ʽ����˹���ɼ������Ӧ2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g�����ʱ䣮
��� �⣺��1���ô���Iʱ����Ӧ��10Сʱ�ڶ�����̼��ת����Ϊ0.18��������̼��Ũ�ȱ仯Ϊ��1.00mol•L-1��0.18=0.18mol/L����Ӧ��10Сʱ�ڶ�����̼��ƽ����Ӧ����Ϊ��v��CO2��=$\frac{0.18mol/L}{10h}$=0.018mol•��L•h��-1����v��H2��=3v��CO2��=0.054mol•��L•h��-1��
�ʴ�Ϊ��0.054mol•��L•h��-1��
��2��A���÷�Ӧǰ��������������䣬�������ݻ��̶������Ի��������ܶ�ʼ�ղ��䣬�ʵ�������������ܶȲ��ٸı�ʱ����Ӧ��һ���ﵽƽ��״̬����A��ȷ��
B�������������ѹǿ�����Ƿ�Ӧ��ϵ�и���ֵ�Ũ�Ȳ��䣬��ѧƽ�ⲻ�����ƶ�������CO2��ת���ʲ��䣬��B����
C��������Ӱ�컯ѧƽ�⣬����CO2ƽ��ת������������Ӧ�����£���������������ת������ȣ���C����
D����������Ӧ�����£�������ķ�Ӧ���ʴ��ڴ�����ģ�˵��������ȴ�����Ĵ�Ч�ʸߣ���D��ȷ��
��ѡAD��
��3��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼŨ�ȣ�mol/L��1.00 1.60 0 0
�仯Ũ�ȣ�mol/L��0.20 0.60 0.20 0.20
ƽ��Ũ�ȣ�mol/L��0.80 1.0 0.20 0.20
K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{0.20mol/L��0.20mol/L}{0.80mol/L����1.0mol/L��^{3}}$=0.050L2•mol-2��
��300��ʱ��ƽ�ⳣ��Ϊ0.050 L2•mol-2��
��4�����ڸ÷�ӦΪ���ȷ�Ӧ���¶�����ѧƽ�����������ƶ�����Ӧ��Ũ�ȼ�С��������Ũ������ѧƽ�ⳣ������ƽ�ⳣ��K��400�棩��K��300�棩��
�ʴ�Ϊ������
��5��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-187.4kJ•mol-1��
2H2��g��+O2��g��=2H2O��g����H=-242.8kJ•mol-1��
�ɸ�˹���ɣ��ڡ�3-�١�2�ɵã�2CH3OH��g��+3O2��g��=2CO2��g��+4H2O��g������H=��-242.8kJ•mol-1����3-��-187.4kJ•mol-1����2=-353.6kJ•mol-1
�ʴ�Ϊ��-353.6kJ•mol-1��
���� ���⿼���˻�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ļ��㡢Ӱ�컯ѧ��Ӧ�������ء��Ȼ�ѧ����ʽ��д����˹���ɵ�Ӧ�õ�֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧ��Ӧ���ʡ���ѧƽ�ⳣ���ı���ʽ�����㷽������ȷ��˹���ɵĺ��弰��Ӧ�÷�����

| A�� | 3-��-4-�һ����� | B�� | 3��4��4-�������� | ||
| C�� | 3��3��4��4-�ļ����� | D�� | 3��5-�������� |
| A�� | ���º�ѹ�£�����������ܶȲ��䣬˵����Ӧ�Ѵ�ƽ�� | |
| B�� | ����ʱͨ�������ѹǿ���䣬���淴Ӧ����Ҳ���� | |
| C�� | �����¶ȿ������̷�Ӧ�ﵽƽ���ʱ�� | |
| D�� | ����ʱͨ��X2��ƽ��������Ӧ�����ƶ���ƽ�ⳣ������ |
| A�� | 1828��¹���ѧ��ά���״���ʵ������ϳ������� | |
| B�� | 19���ͳ�����仯ѧ�ұ�������˹�״�ʹ�á��л���һ�ʣ�������ˡ��л���ѧ���͡��л�������ĸ��� | |
| C�� | 1965���ҹ���ѧ���˹��ϳ��˾���������Եĵ�����--�ᾧţ�ȵ��� | |
| D�� | 1830�꣬�¹���ѧ�����ϣ�������л�������Ķ����������� |
| A�� | ��״�ṹ�ľ۱�ϩ�����Ǹ���ˮ����֬�����������조��ʪ�� | |
| B�� | ���άӦ������ǿ���Ի�����ʹ�� | |
| C�� | ���ó��ٽ�C02������Ϊ��ȡ�ܼ�������ɫ��ѧ | |
| D�� | �����п�������ɱ������壬�Ʋ����������ʧȥ�������� |
| A�� | Ħ�������������Ӷ��ٵ������� | |
| B�� | ���ʵ������ɳ����ĺ��������һ����Ŀ��������ϵ���� | |
| C�� | 1molO2������Ϊ32g•mol-1 | |
| D�� | 22.4L H2�����ʵ���Ϊ1mol |
 �ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ��
�ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ��