题目内容
6.在由Fe、Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,则反应前混合物中Fe、Fe2O3的物质的量之比为( )| A. | 4:3 | B. | 3:4 | C. | 2:3 | D. | 3:2 |
分析 混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,发生反应:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,计算出与HCl反应的Fe的物质的量,进而表示出与Fe3+反应的Fe的物质的量,据此列方程,再根据氯元素守恒列方程,联立方程计算解答.
解答 解:混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,生成氢气物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,
Fe+2H+=Fe2++H2↑
0.01mol 0.01mol
设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,
Fe2O3~2Fe3+~Fe
ymol (x-0.01)mol
根据题意,列方程得:x-0.01=y,
根据氯元素守恒:2x+2y×2=0.1×2,
联立方程,解得:x=0.04mol、y=0.03mol,
则反应前混合物中Fe、Fe2O3的物质的量之比为0.04mol:0.03mol=4:3,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
16.下列做法不能达到实验目的是( )
| A. | 用闻气味的方法鉴别氢气和氧气 | B. | 用氯化钡溶液鉴别盐酸和稀硫酸 | ||
| C. | 观察气体颜色区别氯气和氧气 | D. | 利用丁达尔效应区别溶液和胶体 |
17.下列有关化学研究的正确说法是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| C. | 决定化学反应速率的最主要因素:反应物自身的性质 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6g铁粉与某酸反应失去的电子数一定为0.3NA | |
| B. | 0.2 mol•L-1 Na2SO4溶液中所含Na+的数目为0.4NA | |
| C. | 标准状况下,22.4L氢气和氮气的混合气体中含有的原子总数为2NA | |
| D. | 常温常压下,等质量的O2和H2S分子个数比为1:1 |
11.下列叙述正确的是( )
| A. | CH3COONH4是弱电解质 | |
| B. | 10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管终点读数时,仰视刻度线引起测量结果偏低 |
18.下列叙述中,正确的是( )
| A. | 硫酸的摩尔质量是98g | |
| B. | 1 mol H2O的质量为18g/mol | |
| C. | 摩尔是物质的量的单位 | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
15.用30g乙酸和46g 乙醇反应,如果实际产量是理论产量的85%,则可得到的乙酸乙酯的质量是( )
| A. | 37.4g | B. | 44g | C. | 74.8g | D. | 88g |
16.下列指定反应的离子方程式正确的是( )
| A. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-═AlO2-+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向苯酚钠溶液中通入少量CO2:C6H5O+CO2+H2→C6H5OH+HCO3- | |
| D. | 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-═2MnO2↓+3SO42-+2H2O |

 .
.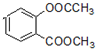 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+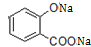 +H2O.
+H2O.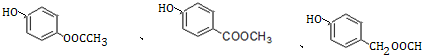 .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).