题目内容
17.下列有关化学研究的正确说法是( )| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| C. | 决定化学反应速率的最主要因素:反应物自身的性质 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
分析 A.要研究化学反应速率影响因素时只能改变一个条件;
B.卤素元素的非金属性越强,其氢化物的稳定性越强,其氢化物在水溶液中电离程度越小;
C.决定化学反应速率的主要因素是物质本身性质,外界因素只是影响因素;
D.溶液和浊液没有丁达尔效应.
解答 解:A.要研究化学反应速率影响因素时只能改变一个条件,如果改变两个条件,无法得出规律,故A错误;
B.卤素元素的非金属性越强,其氢化物的稳定性越强,其氢化物在水溶液中电离程度越小,则相应氢化物的酸性越弱,从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属减弱的规律,故B错误;
C.决定化学反应速率的主要因素是物质本身性质,外界因素只是影响因素,故C正确;
D.溶液和浊液没有丁达尔效应,所以根据丁达尔现象不能将分散系分为溶液、胶体与浊液,故D错误;
故选C.
点评 本题考查物质的分类、非金属性强弱判断、化学反应速率影响因素等知识点,为高频考点,明确分类标准、非金属性强弱判断方法、化学反应速率影响因素与决定因素的关系是解本题关键,易错选项是B.

练习册系列答案
相关题目
5.下列变化中,不属于化学变化的是( )
| A. | Na2O2使有色物质褪色 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 漂白粉使某些染料褪色 |
12.下列措施不合理的是( )
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | 高温下用焦炭还原SiO2制取粗硅 | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用Na2S作沉淀剂,出去沸水中过的Hg2+ |
2.列有关化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质的分子中均不存在化学键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 任何物质内都含有化学键 |
9. 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] | |
| C. | 放电时,正极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 放电时,电解质中的阳离子(EMl+)会发生反应 |
6.在由Fe、Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,则反应前混合物中Fe、Fe2O3的物质的量之比为( )
| A. | 4:3 | B. | 3:4 | C. | 2:3 | D. | 3:2 |
7.下列对一些实验事实的解释正确的是( )
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
| A. | A | B. | B | C. | C | D. | D |
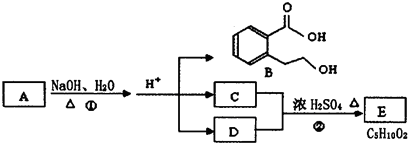
 .
. .
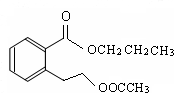
.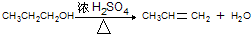 .
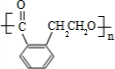
. .
. .
.