题目内容
1.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 5.6g铁粉与某酸反应失去的电子数一定为0.3NA | |
| B. | 0.2 mol•L-1 Na2SO4溶液中所含Na+的数目为0.4NA | |
| C. | 标准状况下,22.4L氢气和氮气的混合气体中含有的原子总数为2NA | |
| D. | 常温常压下,等质量的O2和H2S分子个数比为1:1 |
分析 A、铁与盐酸或稀硫酸反应变为+2价,而和浓硫酸、硝酸反应后变为+3价;
B、溶液体积不明确;
C、求出混合气体的物质的量,然后根据氢气和氮气均为双原子分子来分析;
D、等质量时,分子个数之比等于物质的量之比,与摩尔质量成反比.
解答 解:A、铁与盐酸或稀硫酸反应变为+2价,而和浓硫酸、硝酸反应后变为+3价,故5.6g铁即0.1mol铁和酸反应后可能失去0.2NA个电子,也可能失去0.3NA个电子,故A
错误;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、标况下22.4L混合气体的物质的量为1mol,而氢气和氮气均为双原子分子,故1mol混合物中含2mol原子即2NA个,故C正确;
D、等质量时,分子个数之比等于物质的量之比,与摩尔质量成反比,故分子个数之比为34:32=17:16,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.可用分液漏斗分离的一组化合物是( )
| A. | CCl4与水 | B. | AgCl悬浊液 | C. | 氯化钠与水 | D. | 酒精与水 |
12.下列措施不合理的是( )
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | 高温下用焦炭还原SiO2制取粗硅 | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用Na2S作沉淀剂,出去沸水中过的Hg2+ |
9. 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.图为该电池放电过程示意图,Cn为石墨烯,下列说法正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] | |
| C. | 放电时,正极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 放电时,电解质中的阳离子(EMl+)会发生反应 |
16.下列说法正确的是( )
| A. | 晶体硅是光导纤维的主要成分 | |
| B. | 碳酸钠是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | 在高炉炼铁工业中,炉渣成分为CaCO3 |
6.在由Fe、Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,则反应前混合物中Fe、Fe2O3的物质的量之比为( )
| A. | 4:3 | B. | 3:4 | C. | 2:3 | D. | 3:2 |
13.在饱和澄清石灰水中加入生石灰反应后,恢复至原来温度下列说法正确的是( )
| A. | 溶液的PH不变 | B. | 溶液中氢氧化钙的质量分数增大 | ||
| C. | 溶液中钙离子浓度变大 | D. | 溶液中钙离子的物质的量减少. |
10.下列物质中与0.3 molH2O含有相同氢原子数的是( )
| A. | 0.3molHNO3 | B. | 0.1mol H3PO4 | ||
| C. | 0.2molCH4 | D. | 3.612×1023个HCl分子 |
11.下列化学用语表示正确的是( )
| A. | HClO的电子式: | |
| B. | 质子数为94、中子数为145的钚(Pu)原子:${\;}_{94}^{145}$Pu | |
| C. | 氯离子的结构示意图: | |
| D. | 对二甲苯的结构简式: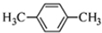 |