题目内容
11.下列叙述正确的是( )| A. | CH3COONH4是弱电解质 | |
| B. | 10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管终点读数时,仰视刻度线引起测量结果偏低 |
分析 A.CH3COONH4在水中完全电离,是强电解质;
B.计算混合后的c(OH-),再计算溶液的PH;
C.根据电荷守恒式和物料守恒式分析;
D.读取滴定管终点读数时,仰视刻度线,导致HCl体积偏大.
解答 解:A.CH3COONH4在水中完全电离,是强电解质,故A错误;
B.10ml0.02mol/L的HCl溶液与10ml0.02mol/L的Ba(OH)2溶液充分混合后,若混合后溶液体积为20ml,反应后的溶液中c(OH-)=$\frac{0.04mol/L×0.01L-0.02mol/L×0.01L}{0.02L}$=0.01mol/L,c(H+)=$\frac{1×10{\;}^{-14}}{0.01}$mol/L=1×10-12mol/L,pH=-lg1×10-12=12,故B正确;
C.电荷守恒得c(CH3COO-)+c(OH-)=c(H+)+c(Na+),物料守恒式c(CH3COO-)+c(CH3COOH)=2c(Na+),二式联立整体可得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;
D.滴定管的小刻度在下、大刻度在上,所以仰视读数导致HCl体积偏大,导致最终实验结果偏高,故D错误;
故选BC.
点评 本题考查较为综合,涉及电解质的分类、PH的计算、中和滴定、溶液中的三大守恒,综合性强,难度较大,其中C是本题的难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.列有关化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质的分子中均不存在化学键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 任何物质内都含有化学键 |
19.下列说法错误的是( )
| A. | 可用“丁达尔现象”区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | BaCl2是一种离子晶体,其在熔融状态下可以导电 | |
| C. | 欲从碘水中得到碘单质,可用酒精做萃取剂 | |
| D. | 欲从KNO3溶液中得到KNO3晶体,可用蒸发结晶法 |
6.在由Fe、Fe2O3组成的混合物中加入100mL2mol•L-1的盐酸,恰好使混合物完全溶解,并放出224mL气体(标准状况),此时向溶液中加入KSCN溶液无明显现象,则反应前混合物中Fe、Fe2O3的物质的量之比为( )
| A. | 4:3 | B. | 3:4 | C. | 2:3 | D. | 3:2 |
16.空气污染已成为人类社会面临的重大威胁.下列物质中,不属于空气污染物的是( )
| A. | NO2 | B. | SO2 | C. | PM2.5 | D. | N2 |
3.下列说法正确的是( )
| A. | 自然界存在大量单质硅 | B. | 光导纤维被广泛应用于信息传输 | ||
| C. | SiO2与任何酸都不起反应 | D. | 盛NaOH溶液的试剂瓶塞可用玻璃塞 |
1.某抗瘤药物中间体的合成路线如下.下列说法正确的是( )

| A. | 吲哚不能使溴的四氯化碳溶液褪色 | |
| B. | 苯甲醛可发生加成、氧化和还原反应 | |
| C. | 可用银氨溶液鉴别苯甲醛和中间体 | |
| D. | 该中间体分子中含有2个手性碳原子 |
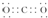 .
.