题目内容
18. A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素请回答下列问题:
(1)写出F基态原子的外围电子排布式3d54s1.
(2)B和C比较,第一电离能较大的元素是N(填元素符号).
(3)甲、乙两分子中含有非极性共价键的是H2O2(填分子式).
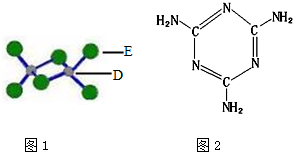
(4)已知化合物丙熔点190℃,沸点183℃,结构如图1所示.
①丙属于分子 晶体.
②丙含有的作用力有BDE(填序号).
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0.1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀.已知该配合物的配位数为6,则戊的化学式为〔CrCl(H2O)5〕Cl2.
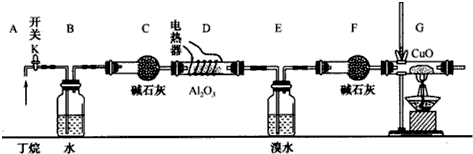
(6)三聚氰胺(结构如右图2)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石.三聚氰胺中N原子的杂化类型是sp2、sp3.
分析 A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂,这说明甲是水,则A为H元素,C为O元素,乙为双氧水;B、C相邻且同周期,且C原子中含有8种运动状态不同的电子,则C是氧元素,B是N元素;D是地壳中含量最多的金属元素,属于D是Al元素;E元素为同周期电负性最大的元素,且E的原子序数大于铝元素的,所以E是Cl元素;D和E可形成化合物丙,则丙是氯化铝,F为第四周期未成对电子数最多的元素,因此F是Cr元素,据此答题.
解答 解:A、B、C、D、E、F分别为:H、N、O、Al、Cl、Cr,甲和乙分别为H2O、H2O2,丙为Al2Cl6.
(1)F为Cr元素,根据构造原理可知,3d轨道处于半满状态比较稳定,则Cr的基态原子的外围电子排布式为:3d54s1,
故答案为:3d54s1;
(2)由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的为N元素,
故答案为:N;
(3)根据分析可知,甲为水,乙为双氧水,含有非极性共价键的是H2O2,
故答案为:H2O2;
(4)①根据图1可知,丙是Al2Cl6,化合物丙熔点190℃,沸点183℃,则丙为分子晶体,
故答案为:分子;
②Al2Cl6是分子晶体,分子间存在范德华力,分子内有极性共价键和配位键,
故选:BDE;
(5)甲为水,元素E为Cl,配合物戊由F3+与A、C、E构成;生成的28.7g白色沉淀是AgCl,氯化银的物质的量为:$\frac{28.7g}{143.5g/mol}$=0.2mol,0.1mol戊能够电离出0.2mol氯离子,说明该化合物能电离出2个氯离子,再根据配位数是6以及Cr元素的化合价为+3价可知,戊中含有5个水分子、1个氯离子,则戊的化学式为:[Cr(H2O)5Cl]Cl2,
故答案为:[Cr(H2O)5Cl]Cl2;
(6)根据三聚氰胺的结构简式可知,C=N中为平面结构,-NH2中为三角锥结构,杂化形式分别是sp2、sp3,
故答案为:sp2、sp3.
点评 本题考查位置结构与性质的关系,比较全面考查学生有关元素推断知识和灵活运用知识的能力,有利于培养学生的应试能力和逻辑推理能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 200mL | B. | 250 mL | C. | 500mL | D. | 560mL |
| A. | NaBH4中B元素化合价为+3 | B. | 每生成11.2 L氏转移Na个电子 | ||
| C. | NaBH4在反应中作氧化剂 | D. | NH3BH3在反应中属于还原产物 |
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法不正确的是( )| A. | 1mol该有机物可与2mol钠反应 | |
| B. | 该有机物可以发生酯化、加成、醇催化氧化 | |
| C. | 1mol碳酸钠可与2mol该物质反应产生1mol二氧化碳 | |
| D. | 该有机物中含有碳碳双键、羟基、羧基等官能团 |
| A. |  移开加热的蒸发皿 | B. |  给试管加热 | ||
| C. |  滴加液体 | D. |  过滤 |
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-3-乙基庚烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,3-二甲基戊烷 |

 ; (2)铝离子的结构示意图:
; (2)铝离子的结构示意图: ;
;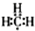
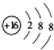 ; (6)NH4Cl的电子式:
; (6)NH4Cl的电子式: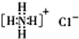 ;
;