题目内容
5.下列说法正确的是( )| A. | 某盐溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯上灼烧时,火焰呈黄色,说明原溶液中一定含有NaCl | |
| D. | 某溶液中加入BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
分析 A.氨气使湿润红色石蕊试纸变蓝气体;
B.白色沉淀可能为硫酸银、AgCl等;
C.焰色反应为元素的性质;
D.白色沉淀为AgCl或BaSO4.
解答 解:A.氨气使湿润红色石蕊试纸变蓝气体,则说明原溶液中存在NH4+,故A正确;
B.白色沉淀可能为硫酸银、AgCl等,则原溶液可能含Cl-或SO42-等,故B错误;
C.焰色反应为元素的性质,则火焰呈黄色,说明原溶液中一定含钠离子,可能为NaCl、NaOH等,故C错误;
D.白色沉淀为AgCl或BaSO4,原溶液中有SO42-或银离子,但二者不能同时存在,故D错误;
故选A.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意离子检验时排除干扰离子,题目难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
14.下列情况不能说明硫单质的氧化性比氯气弱的是( )
| A. | 与铁反应时分别生成硫化亚铁和氯化铁 | |
| B. | 与氢气反应的条件分别是加热和点燃(或光照) | |
| C. | 硫化氢的溶解度比氯化氢小得多 | |
| D. | 氯气能从氢硫酸中置换出单质硫 |
15.下列有关物质的用途中,运用了物质的化学性质的是( )
| A. | 用胶状氢氧化铝凝聚水中的悬浮物进行净水 | |
| B. | 用红棕色氧化铁制造红色油漆 | |
| C. | 氢氧化铝作为医用的胃酸中和剂 | |
| D. | 用氧化铝制造耐火坩埚和耐火管 |
12.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成44.8LN2 | |
| B. | 有0.250molKNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.00mol |
10.某温度下,反应SO2(g)+$\frac{1}{2}$(g)?SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)?2SO2(g)+O2(g)的平衡常数K2的值为( )
| A. | 400 | B. | 500 | C. | 4×10-4 | D. | 2.5×10-3 |
17.在恒温、恒容下发生反应:A(s)+B(g)=C(g)+D(g)△H<0.则下列判断正确的是( )
| A. | 向该容器中加入少量A,反应速率增大 | |
| B. | 向该容器中充入氩气,反应速率增大 | |
| C. | 将粉末状A代替块状A能加快反应 | |
| D. | 该反应为放热反应,无需加热即可发生 |
14.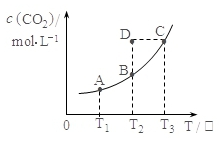 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T 2时,若反应处于状态D,则一定有V 正<V 逆 | |
| C. | 反应CO(g)+H 2O(g)?CO 2(g)+H 2(g) 的△H>0 | |
| D. | 若T 1、T 2时的平衡常数分别为K 1、K 2,则K 1<K 2 |
15.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 电解熔融化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |