题目内容
14.下列情况不能说明硫单质的氧化性比氯气弱的是( )| A. | 与铁反应时分别生成硫化亚铁和氯化铁 | |
| B. | 与氢气反应的条件分别是加热和点燃(或光照) | |
| C. | 硫化氢的溶解度比氯化氢小得多 | |
| D. | 氯气能从氢硫酸中置换出单质硫 |
分析 比较氧化性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.
解答 解:A、元素的氧化性越强,与变价金属反应的化合价越高,所以与铁反应时分别生成硫化亚铁和氯化铁能说明硫单质的氧化性比氯气弱,故A不选;
B、元素的氧化性越强,与氢气反应越容易,所以与氢气反应的条件分别是加热和点燃能说明硫单质的氧化性比氯气弱,故B不选;
C、硫化氢的溶解度比氯化氢小得多,不能说明硫单质的氧化性比氯气弱,故C选;
D、氯气能与硫化氢反应生成硫,说明氯的氧化性比硫强,故D不选;
故选C.
点评 本题考查氧化性的比较,学习中注意把握比较氧化性强弱的角度,题目难度不大.

练习册系列答案
相关题目
7.下列变化不属于取代反应的是( )
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 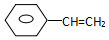 +4H2$\stackrel{一定条件}{→}$ +4H2$\stackrel{一定条件}{→}$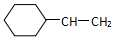 | |
| C. | 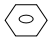 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$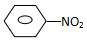 +H2O +H2O | |
| D. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl |
5.未来新能源的特点是资源丰富,在使用过程中对环境无污染或污染很小,且可以再生.下列属于未来新能源开发方向的是 ( )
①天然气 ②煤 ③燃料电池 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
①天然气 ②煤 ③燃料电池 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
| A. | ①②③④ | B. | ③④⑤⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①④⑤⑥⑦ |
9.硼元素的平均相对原子质量为10.8,则硼在自然界中的两种同位素${\;}_{\;}^{10}$B和B${\;}_{\;}^{11}$的原子个数比为( )
| A. | 1:4 | B. | 10:11 | C. | 4:1 | D. | 5:22 |
19.下列指定反应的离子方程式正确的是( )
| A. | NaHCO3的水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电解电解氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2OH-+H2↑+Cl2↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-?2Fe2++I2+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
6.氯元素的相对原子质量为35.5,已知自然界中氯有35Cl、37Cl两种同位素原子,其中37Cl占质量分数为( )
| A. | 75% | B. | >75% | C. | <75% | D. | 不能确定 |
3.已知某溶液中含有Na+、Ca2+、Ag+三种阳离子,那么溶液中的阴离子可能是( )
| A. | NO3- | B. | Cl- | C. | Br- | D. | CO32- |
5.下列说法正确的是( )
| A. | 某盐溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入硝酸银溶液时,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯上灼烧时,火焰呈黄色,说明原溶液中一定含有NaCl | |
| D. | 某溶液中加入BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |