题目内容
13.实验室需要配制480m L 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO427.2mL(保留一位小数)分析 依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据配制溶液体积及容量瓶规格选择需要容量瓶,溶液稀释过程中所含溶质的物质的量保持不变,据此计算需要浓硫酸的体积.
解答 解:质量分数为98%,密度为1.84g/cm3的浓H2SO4,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;配制480m L 1mol/L H2SO4溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积V,则依据溶液稀释过程中所含溶质的物质的量保持不变得:V×18.4mol/L=500mL×1mol/L,解得V=27.2mL,
故答案为:27.2.
点评 本题考查了一定物质的量浓度溶液的配制,侧重考查有关物质的量浓度计算,明确物质的量浓度计算公式及溶液稀释规律,熟悉容量瓶规格选择方法,题目难度不大.

练习册系列答案
相关题目
3.已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol,相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系 能量的变化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ | |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 平衡时,两容器中CO2的浓度相等 | |
| C. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| D. | 容器①中CO反应速率等于H2O(g)的反应速率 |
4.由于金属锌本身的价值不高,在我国工业锌废料的回收利用率比较低.某课题组研究利用含少量铜、铁的粗锌制备硫酸锌及相关物质的资源综合利用,其工艺流程图(图中加入的物质均为足量)及有关数据如下:
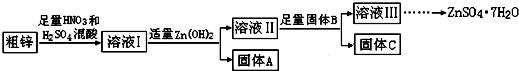
请回答下列问题:
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.

| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
(1)固体A的主要成分是Fe(OH)3;加入固体B的主要作用是除去溶液Ⅱ中的Cu2+.
(2)粗锌中的铜与稀混酸溶液反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)若溶液II中c(Cu2+)为0.05mol•L-1,则溶液II的pH≤5.
(4)若B是Zn,取8.320gC完全溶解于500mL 1mol•L-1稀硝酸中,共收集到2240mL气体,再向所得溶液中加入NaOH溶液至刚好生成沉淀最多,此时所得沉淀质量(m)的取值范围是13.42;若B是另一种物质,取部分C于试管中,加入盐酸后产生了有臭鸡蛋味气体,则该反应的离子方程式为ZnS+2H+=H2S↑+Zn2+.
(5)溶液III还可以与(NH4)2S溶液反应制备ZnS,实际生产中选用(NH4)2S溶液而不是Na2S溶液作为反应物,是因为后者制得的ZnS中会含有较多的Zn(OH)2杂质.
1.如图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是( )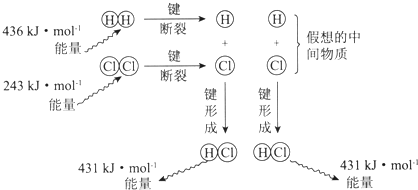

| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
18.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(5)己知:
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
5.实验室需配制480mL 0.1mol•L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
2.在下列反应中,既属于离子反应又属于氧化还原反应的是( )
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
11.某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.

(1)写出装置A中发生反应的离子方程式:4H++2Cl-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
(4)①若假设一成立:己知C中有0.1mol Cl2参加反应.可推知C中反应的化学方程式为2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O.
②若假设二成立:请设计最佳实验方案,测定C中NaHCO3的质量分数$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$×100%.

(1)写出装置A中发生反应的离子方程式:4H++2Cl-+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
(2)写出试剂Y的名称:饱和食盐水.
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物.可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究.
①提出合理假设:
假设一:存在两种成分:NaHCO3和NaCl
假设二:存在三种成分:NaHCO3和NaCl、Na2CO3.
②设计方案,进行实验.请写出实验步骤以及预期现象和结论(可不填满).
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴BaCl2溶液 | ①若无明显现象,证明固体中不含碳酸钠;②若溶液变浑浊,证明固体中含有碳酸钠. |
| 步骤3:向B试管中滴加AgNO3溶液和稀硝酸 | 若溶液变浑浊,结合步骤2中的①,则假设一成立;结合步骤2中的②,则假设二成立. |
②若假设二成立:请设计最佳实验方案,测定C中NaHCO3的质量分数$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$×100%.