题目内容
13.能短缺是人类社会面临的重大问题,世界各国都在努力寻找新能,探求绿色能的开发.甲醇是一种可再生能,是一种污染性较小,热值较大的能,因而具有广泛的开发价值和良好的应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g),△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H2
①上述反应符合“原子经济”原则的是Ⅰ(填“I’’或“Ⅱ”).
②反应I△H1<0(填“>”、“=”或“<”),说明生成物的总能量一定<(填“>”、“=”或“<”)应物的总能量.
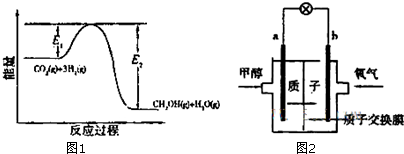
③反应Ⅱ‘反应历程如图1,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1,减小、E2减小、△H2不变(填“增大”“减小”“不变”).
(2)最新研制的一种新型甲醇(CH3OH)电池示意图如图2,电池的两极分别充人甲醇和氧气(池内为酸性介质).
(3)则电池工作时b(填a或b)为正极,
(4)a极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
分析 (1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中;
②反应I△H1<0,说明反应是放热反应,结合能量守恒判断能量大小;
③根据催化剂的作用分析,催化剂改变反应速率,降低反应的活化能,不改变化学平衡,反应焓变和起始和终了物质能量有关,与变化过程无关;
(3)电解池与电源正极相连的为阳极,与电源负极相连的为电解池的阴极;
(4)根据甲醇燃料电池的原理分析,燃料在负极失电子发生氧化反应,氧气在正极得到电子发生还原反应,酸性介质中生成水.
解答 解:(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ符合“原子经济”,
故答案为:Ⅰ;
②反应Ⅰ△H1<0,说明反应是放热反应,则生成物的总能量一定小于反应物的总能量,
故答案为:<;
③在反应体系中加入催化剂,反应速率增大,降低了活化能,E1、E2都减小,反应焓变和起始和终了物质能量有关,与变化过程无关反应热不变,
故答案为:减小;减小;不变;
(3)甲醇电池中,通入氧气的b电极为正极,通入甲醇的一极为负极,
故答案为:b;
(4)在酸性介质下,甲醇放电生成CO2,电极方程式为:CH3OH+H2O-6e-=CO2+6H+;
故答案为:CH3OH+H2O-6e-=CO2+6H+.
点评 本题考查了反应热、化学平衡影响因素、催化剂原理及燃料电池等,难度不大,注意掌握电解池和原电池原理的应用.

练习册系列答案
相关题目
3.下列状态的物质,既能导电又属于电解质的是( )
| A. | 盐酸 | B. | NH3 | C. | 熔融的K2O | D. | BaSO4晶体 |
4.下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
| 选项 | 离 子 | 要 求 |
| A | K+、NO3-、Cl-、SO42- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、CO32-、Cl- | 逐滴加入盐酸立即有气体产生 |
| C | Na+、Cu2+、Mg2+、SO42- | 逐滴加入NaOH溶液立即有沉淀产生 |
| D | H+、NH4+、Al3+、SO42- | 逐滴加入NaOH溶液立刻有气体产生 |
| A. | A | B. | B | C. | C | D. | D |
8.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: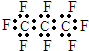 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 一个全氟丙烷分子中有10个共用电子对 |
5.下列除去杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHC03固体 | Na2C03固体 | / | 加热 |
| B | Al2O3 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
3.下列物质属于电解质的是( )
| A. | O2 | B. | N2 | C. | CH4 | D. | HCl |
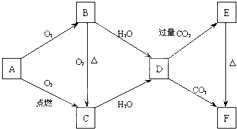 如图所示,A、B、C、D、E、F为金属钠或钠的化合物.
如图所示,A、B、C、D、E、F为金属钠或钠的化合物.