题目内容
13.下列说法正确的是( )| A. | 常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3 | |
| B. | 利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- | |
| C. | 常温时,0.1mol•L-1盐酸中由水电离出的c(H+)<10-7mol/L | |
| D. | 氯化钠溶于水发生电离,电离方程式为:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- |
分析 A.铁离子发生水解,导致铁离子的数目减小;
B.碳酸根离子的水解分步进行,电离方程式写出第一步即可;
C.盐酸中氢离子抑制了水的电离,溶液中氢氧根离子是水的电离的;
D.氯化钠的电离不需要通电,在溶液中可以电离出钠离子和氯离子.
解答 解:A.常温时,FeCl3溶液中,铁离子部分水解,导致铁离子数目减少,则溶液中Fe3+与Cl-的个数之比小于1:3,故A错误;
B.利用Na2CO3溶液可除油污,碳酸根离子的水解分步进行,以第一步为主,正确的离子方程式为:CO32-+H2O?HCO3-+OH-,故B错误;
C.常温时,0.1mol•L-1盐酸中的氢离子抑制了水的电离,由水电离出的c(H+)<10-7mol/L,故C正确;
D.氯化钠溶于水发生电离,不需要通电,正确的电离方程式为:NaCl=Na++Cl-,故D错误;
故选C.
点评 本题考查了盐的水解原理及其应用,题目难度不大,涉及水的电离及其影响、盐的水解原理、电离方程式书写等知识,注意掌握酸、碱、盐溶液对水的电离的影响,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
1.下列事实能够证明Al2O3中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 易溶于水 | D. | 熔化时能导电 |
18.下列各组粒子中属于同位素的是( )
| A. | 24Mg 和 24Na | B. | O2 和 O3 | C. | H2 和 D2 | D. | 16O 和 18O |
5.100mL 6mol•L-1的 H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体.
①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③④⑤ |
2.据美国《科学》杂志报道:在 40GPa 高压下,用激光器加热到1800K,制得具有高熔点、高硬度的二氧化碳晶体.下列关于该晶体的说法正确的是( )
| A. | 该晶体属于分子晶体,可用作制冷材料 | |
| B. | 该晶体中碳原子在空间的分布结构与金刚石相似 | |
| C. | 该晶体的熔点低于二氧化硅 | |
| D. | 1mol 晶体中含 4 mol C-O 键 |
 (含位置)氮元素N,两个氢离子2H+,氧分子O2.
(含位置)氮元素N,两个氢离子2H+,氧分子O2.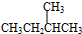 与
与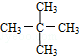 G.
G.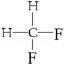 与
与 
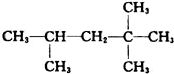 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为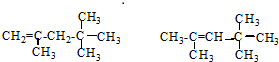 .
.