题目内容
5.100mL 6mol•L-1的 H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③④⑤ |
分析 适当降低氢离子浓度、将Zn换为不如Zn活泼且能与氢离子反应生成氢气的金属能减缓反应速率,不影响生成氢气总量,则酸最终电离出氢离子总量不变,据此分析解答.
解答 解:①Na2CO3溶液与硫酸反应,消耗氢离子,生成氢气的量减小,故错误;
②水硫酸的浓度减少,但氢离子的物质的量不变,可达到减缓反应进行的速率,但又不影响生成氢气的总量,故正确;
③K2SO4溶液,相当于加水,可达到减缓反应进行的速率,但又不影响生成氢气的总量,故正确;
④加入醋酸钠固体,溶液中氢离子浓度降低,反应速率降低,但最终电离出氢离子物质的量不变,则生成氢气总量不变,故正确;
⑤Na2SO4固体,无影响,故错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、物质性质是解本题关键,题目难度不大.

练习册系列答案
相关题目
15.如果a g某气体中含有的分子数为b,则c g该气体在标况下的体积是( )
| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
13.下列说法正确的是( )
| A. | 常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3 | |
| B. | 利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- | |
| C. | 常温时,0.1mol•L-1盐酸中由水电离出的c(H+)<10-7mol/L | |
| D. | 氯化钠溶于水发生电离,电离方程式为:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- |
20.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将 SO2通入水中 | B. | 烧碱溶于水 | C. | 将 HCl 通入水中 | D. | NaHSO4溶于水中 |
17.下列有关化学用语正确的是( )
| A. | 核内有 8 个中子的碳原子:68C | B. | 羰基硫(COS)的结构式: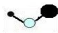 | ||
| C. | 乙烯的比例模型: | D. | NH4Br 的电子式: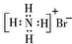 |
14.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将58.5gNaC1溶解于1L水中配成的溶液 | |
| B. | 将80gSO3溶于水并配成1L溶液 | |
| C. | 将100mI.0.5mol•L-1NaNO3溶液加热蒸发掉50g水之后的溶液 | |
| D. | 含2molK+的K2SO4溶液 |

 .
. .
.