题目内容
18.下列各组粒子中属于同位素的是( )| A. | 24Mg 和 24Na | B. | O2 和 O3 | C. | H2 和 D2 | D. | 16O 和 18O |
分析 质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、中子数不同,研究对象为原子.
解答 解:A.24Mg和24Na质子数分别为12、11,两者不同,属于不同元素的原子,不属于同位素,故A错误;
B.氧气和臭氧都是由氧元素组成的不同单质,为同素异形体,不属于同位素,故B错误;
C.H2和D2都是由氢元素组成的单质,结构相同,为同一物质,故C错误;
D.16O和18O质子数相同为8,中子数不同分别为8、10,是氧元素不同核素,互为同位素,故D正确;
故选D.
点评 本题主要考查了同位素为概念的理解,注意H2和D2的结构相同,为同一物质,题目较简单.

练习册系列答案
相关题目
8.短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物很多的元素,且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍.下列叙述不正确的是( )
| A. | 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X) | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 | |
| D. | 由X、Y、Z、W四种元素组成的两种化合物不能发生化学反应 |
9.下列说法正确的是( )
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 石油分馏、煤的干馏均为物理变化 | |
| D. | 淀粉、蛋白质和天然橡胶均是天然高分子化合物 |
6.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示: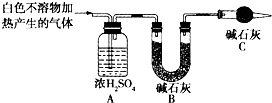
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 ;
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 ②稀盐酸 | ③产生气泡沉淀全部溶解 | 白色不溶物可能含有猜测2中不溶物 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④CO32- |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 ;
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行.
13.下列说法正确的是( )
| A. | 常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3 | |
| B. | 利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- | |
| C. | 常温时,0.1mol•L-1盐酸中由水电离出的c(H+)<10-7mol/L | |
| D. | 氯化钠溶于水发生电离,电离方程式为:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- |
