题目内容
1.下列事实能够证明Al2O3中一定存在离子键的是( )| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 易溶于水 | D. | 熔化时能导电 |
分析 含有离子键的化合物在熔融状态下能导电,只含共价键的化合物在熔融状态下不导电,要证明氧化铝中一定存在离子键,只要熔融状态氧化铝能导电即可,据此分析解答.
解答 解:A.氧化铝不溶于水,其水溶液不导电,故A错误;
B.熔点的高低与离子键无关,如金刚石中只含共价键,但熔点较高,故B错误;
C.氧化铝不溶于水,且不能根据是否易溶于水判断离子键,故C错误;
D.氧化铝熔融状态下能导电,说明熔融状态下电离出自由移动的阴阳离子,所以含有离子键,故D正确;
故选D.
点评 本题考查离子化合物和共价化合物的判断,侧重考查基本概念,明确物质构成微粒是解本题关键,注意不能根据溶解性大小、熔沸点高低判断离子键,为易错题.

练习册系列答案
相关题目
12.下列实验能获得成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液 |
9.下列说法正确的是( )
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 石油分馏、煤的干馏均为物理变化 | |
| D. | 淀粉、蛋白质和天然橡胶均是天然高分子化合物 |
6.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示: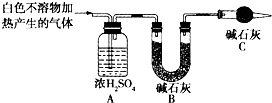
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 ;
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行.
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 ②稀盐酸 | ③产生气泡沉淀全部溶解 | 白色不溶物可能含有猜测2中不溶物 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④CO32- |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 ;
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:NaHCO3溶液中存在平衡,HCO3-?H++CO32-、H2O?H++OH-;Mg和H+反应生成氢气和镁离子,镁离子和氢氧根离子、碳酸根离子反应生成难溶物Mg(OH)2•2MgCO3,则H+、OH-、CO32-的浓度均减小,促使上述两平衡均向右进行.
13.下列说法正确的是( )
| A. | 常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3 | |
| B. | 利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- | |
| C. | 常温时,0.1mol•L-1盐酸中由水电离出的c(H+)<10-7mol/L | |
| D. | 氯化钠溶于水发生电离,电离方程式为:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- |

 .
. .
.
 2NO2△H>0)
2NO2△H>0)