题目内容
16.某化学兴趣小组学生设计了制取KClO3和氯水的实验(装置如图所示),并进行相关性质的探究.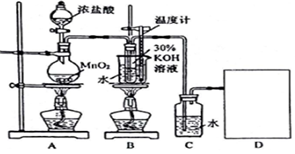
请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.
分析 (1)氯气有毒,过量的氯气不能直接排放到空气中应进行尾气处理,结合氯气能够与氢氧化钠反应,被氢氧化钠溶液吸收画出尾气处理装置;
二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;依据方程式可知2Cl-~Cl2~2e-,据此当产生2.24mL(标准状况)Cl2时,转移电子数目;
(2)氯气与氢氧化钾在加热条件下发生歧化反应生成氯化钾和氯酸钾、水;实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质;
(3)从高温的氯酸钾溶液中得到氯酸钾晶体,需要经过冷却结晶、过滤、洗涤、干燥;
①氯气与水反应生成盐酸与次氯酸,盐酸具有酸性,次氯酸具有漂白性,据此判断现象;
②氯水中氯气、HClO、氯离子、次氯酸根离子都含有氯离子,将氧化性微粒物质还原成Cl-,再利用生成AgCl沉淀的质量测定氯水中氯元素总量,选择H2O2为还原剂;
(4)依据盐类水解的规律:越弱越水解设计实验;
(5)依据表格中数据:碘化钾物质的量、氯酸钾的质量相等,可知该实验目的比较硫酸浓度对反应产物的影响,则应保证溶液体积相等,碘化钾、氯酸钾的浓度相等,据此确定a值;碘遇到淀粉变蓝,此系列实验中加入淀粉能够使现象更明显.
解答 解:(1)氯气有毒,不能直接排放到空气中,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气,装置图为: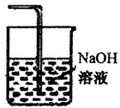 ;
;
故答案为: ;
;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,依据方程式可知2Cl-~Cl2~2e-,
当产生2.24mL(标准状况)Cl2时物质的量为:$\frac{2.24×1{0}^{-3}L}{22.4L/mol}$=10-4mol,转移电子数为:10-4mol×6.02×1023mol-1=1.204×1022;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;1.204×1022;
氯气与氢氧化钾在加热条件下发生歧化反应生成氯化钾和氯酸钾、水,离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O;实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率;
故答案为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O;提高氯酸钾的纯度;
(3)从高温的氯酸钾溶液中得到氯酸钾晶体,需要经过冷却结晶、过滤、洗涤、干燥;
故答案为:冷却结晶;
①氯气与水反应生成盐酸与次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以滴入石蕊后,溶液先变红后褪色;
故答案为:先变红后褪色;
②氯水中氯气、HClO、氯离子、次氯酸根离子都含有氯离子,将氧化性微粒物质还原成Cl-,再利用生成AgCl沉淀的质量测定氯水中氯元素总量,选择H2O2为还原剂,将氯气、次氯酸、次氯酸根离子还原为氯离子;
故答案为:将氯气、次氯酸、次氯酸根离子还原为氯离子;
(4)欲证明相同条件下HClO的电离常数大于HCO3-,分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH,依据越弱越水解规律,对应钠盐的pH值越大,则其对应酸越弱,电离常数越小;
故答案为:分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH;
(5)依据表格中数据:碘化钾物质的量、氯酸钾的质量相等,可知该实验目的比较硫酸浓度对反应产物的影响,则应保证溶液体积相等,碘化钾、氯酸钾的浓度相等,依据数据4可知,溶液总体积为10mL,则a为9.0mL;碘遇到淀粉变蓝,此系列实验中加入淀粉能够使现象更明显;
故答案为:9.0;淀粉溶液.
点评 本题为实验题以氯水、氯酸钾的制备为载体考查氯及其化合物的性质,侧重考查化学仪器的使用、实验方案的设计与评价、离子方程式的书写等知识,掌握实验室制取氯气原理,明确氯气、氯水的性质是解答的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ H+ ClO- NO3- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g) (Ⅰ)
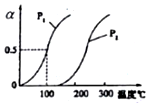
CH4的平衡转化率与温度、压强的关系如右图.
①己知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为0.0030mol•L-1•min-1.
②图中的P1<P2(填“<”“>”或“=”),100℃时平衡常数的值为2.25×10-4.
③在其它条件不变的情况下降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)(Ⅱ)
④该反应的△H<0,△S<0.(填“<”“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1molCO和3molH2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
| 选项 | 实验目的 | 操作方法 | 原理 |
| A | 验证淀粉水解产物是否具有还原性 | 取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸 | 水解产物为葡萄糖,与新制氢氧化铜悬浊液共热出现砖红色沉淀 |
| B | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 | 溴易溶于苯 |
| C | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 | 加入NaOH促进FeCl3溶液水解,从而得到氢氧化铁胶体 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(水溶液呈中性),观察溶液颜色变化 | 加入醋酸铵固体,使CH3COONa溶液水解平衡逆向移动,颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加热 | B. | 投入金属钠 | C. | 加入NaHSO4固体 | D. | 以惰性电极电解 |
| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
| A. | 二者的分子个数之比为16:17 | |
| B. | 二者的原子个数之比为17:16 | |
| C. | 二者的氢原子个数之比为17:12 | |
| D. | 同温同压下两种气体的体积之比为16:17 |
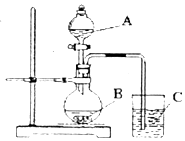 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.