题目内容
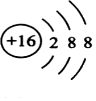
19.A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素.B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期.(1)F的离子结构示意图为
 .
.(2)D、E、F的离子半径由大到小的顺序为S2->O2->Al3+(填离子符号).
(3)写出能证明G比F非金属性强的一个化学方程式Cl2+H2S=2HCl+S↓.
(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为
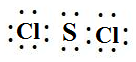 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.(5)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为
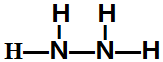 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.(6)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为150或350mL.
分析 A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素,B、C、D均能与A形成10电子分子,F与D同主族,F与G同周期,所以D不是F而是O,F不是Cl而是S,故A为H,B为C、C为N、D为O、F为S、G为Cl,E单质可用于焊接钢轨,则E为Al,以此解答该题.
解答 解:(1)由上述分析可知,F为S,则F的离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)由上述分析可知,D为O、E为Al,F为S,则D、E、F的离子半径由大到小的顺序为S2->O2->Al3+,故答案为:S2->O2->Al3+;
(3)F为S、G为Cl,氯气能将硫置换出来说明Cl比S非金属性强,则化学方程式为Cl2+H2S=2HCl+S↓,故答案为:Cl2+H2S=2HCl+S↓;
(4)F为S、G为Cl,则F和G的一种化合物甲中所有原子均为8电子稳定结构,故甲为SCl2,电子式为: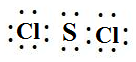 ,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,所以该反应的化学方程式为 3SCl2+4H2O=2S+H2SO4+6HCl,故答案为:
,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,所以该反应的化学方程式为 3SCl2+4H2O=2S+H2SO4+6HCl,故答案为: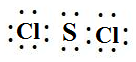 ; 3SCl2+4H2O=2S+H2SO4+6HCl;
; 3SCl2+4H2O=2S+H2SO4+6HCl;
(5)A为H,C为N、D为O,则C能分别与A和D按原子个数比1:2形成化合物乙和丙,所以乙的结构式为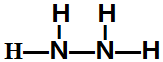 ,丙为NO2.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,则该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol;.故答案为:
,丙为NO2.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,则该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol;.故答案为: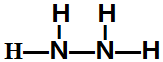 ;2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol;
;2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol;
(6)若碱不足,由AlCl3+3NaOH═Al(OH)3↓+3NaCl,n(NaOH)=$\frac{3.9g}{78g/mol}$×3=0.15mol,则V(NaOH)=$\frac{0.15mol}{1mol/L}$=0.15L=150mL,
若碱过量,则由AlCl3+3NaOH═Al(OH)3↓+3NaCl,
1 3 1
0.1mol 0.3mol 0.1mol
Al(OH)3+NaOH═NaAlO2+2H2O,
0.05mol 0.05mmol
则消耗的n(NaOH)=0.3mol+0.05mol=0.35mol,
则V(NaOH)=$\frac{0.35mol}{1mol/L}$=0.35L=350mL,
故答案为:150或350.
点评 本题考查无机物的推断,元素的推断较简单,熟悉元素及化合物的性质及利用反应的计算等即可解答,题目难度中等.

| A. | 电解稀硫酸,实质是电解水,溶液pH不变 | |
| B. | 电解氢氧化钠稀溶液,溶液浓度增大,pH变小 | |
| C. | 电解氯化钠溶液,溶液浓度减小,pH不变 | |
| D. | 电解硫酸铜溶液,要消耗OH-溶液,pH变小 |
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ H+ ClO- NO3- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
| A. | 34S原子核内中子数为16 | B. | 2H+的酸性比1H+的酸性更强 | ||
| C. | 16O与18O的化学性质几乎完全相同 | D. | 13C和15N原子核内的质子数相差2 |
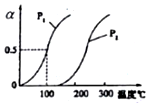 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g) (Ⅰ)
CH4的平衡转化率与温度、压强的关系如右图.
①己知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为0.0030mol•L-1•min-1.
②图中的P1<P2(填“<”“>”或“=”),100℃时平衡常数的值为2.25×10-4.
③在其它条件不变的情况下降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)(Ⅱ)
④该反应的△H<0,△S<0.(填“<”“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1molCO和3molH2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
| 选项 | 实验目的 | 操作方法 | 原理 |
| A | 验证淀粉水解产物是否具有还原性 | 取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸 | 水解产物为葡萄糖,与新制氢氧化铜悬浊液共热出现砖红色沉淀 |
| B | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 | 溴易溶于苯 |
| C | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 | 加入NaOH促进FeCl3溶液水解,从而得到氢氧化铁胶体 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(水溶液呈中性),观察溶液颜色变化 | 加入醋酸铵固体,使CH3COONa溶液水解平衡逆向移动,颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |