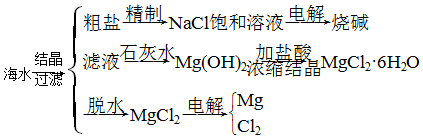题目内容
11. 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.(1)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式2FeCl3+Fe═3FeCl2.
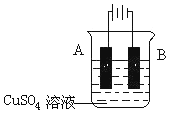
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下:
请回答:
①A电极对应的金属是铜(写元素名称),
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为0.08mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
分析 (1)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,铁和氯化铁发生氧化还原反应生成氯化亚铁;
(2)①电镀时,镀层作阳极,镀件作阴极;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算;
③作原电池负极的金属易被腐蚀.
解答 解:(1)铁锈的成分是Fe2O3•xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生氧化还原反应生成氯化亚铁,反应方程式为2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(2)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,故答案为:铜;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,所以阴极上析出铜的质量=5.12g×$\frac{1}{2}$=2.56g,转移电子的物质的量=$\frac{2.56g}{64g/mol}$=0.08 mol,
故答案为:0.08;
③铜、铁和电解质溶液构成的原电池中,铁作负极而加速被腐蚀,铁、锌和电解质溶液构成的原电池中,铁作正极被保护,所以镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
点评 本题以铁为载体考查了原电池和电解池原理等知识点,根据电镀原理、金属的腐蚀与防护来分析解答即可,易错题是(2)②,很多同学往往认为两极的质量差全部为阴极析出的铜而导致错误,为易错点.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
1.向含有amol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液发生反应的离子方程式,其中正确的是( )
| A. | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C. | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D. | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
6.下列说法不能说明H3PO4的酸性弱于H2SO4的是( )
| A. | 非金属性P<S | |
| B. | H3PO4溶液的导电能力弱于H2SO4溶液 | |
| C. | Na3PO4溶液呈碱性,Na2SO4溶液呈中性 | |
| D. | H2SO4溶液与Na3PO4反应可以生成H3PO4和Na2SO4 |
3.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| C | 证明盐类水解是吸热反应 | 在醋酸钠溶液中滴入酚酞试液,加热后红色加深 |
| D | 证明难溶物存在沉淀溶解平衡 | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入 NaI固体产生黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |


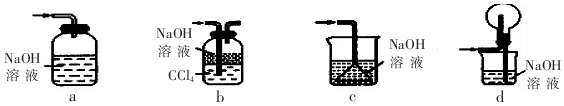
 用图中的简易装置可以进行气体的发生和收集.
用图中的简易装置可以进行气体的发生和收集.