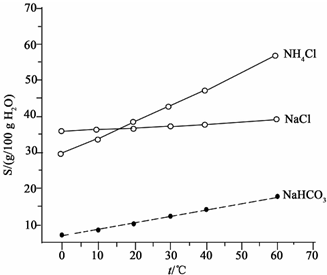
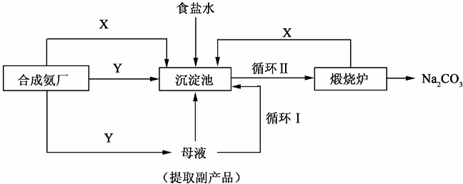
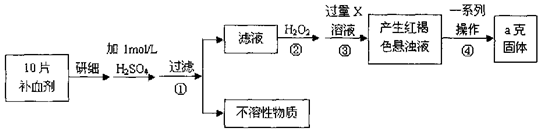
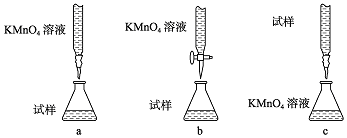
题目内容
9.在强酸溶液中,下列各组离子能够大量共存的是( )| A. | Mg2+、Ca2+、HCO3-、Cl- | B. | Fe2+、Ca2+、Cl-、NO3- | ||
| C. | K+、Fe2+、SO42-、Br- | D. | Na+、K+、SO42-、AlO2- |
分析 强酸性溶液中存在大量氢离子,
A.碳酸氢根离子与氢离子反应;
B.酸性条件下硝酸根离子能够氧化亚铁离子;
C.四种离子之间不反应,都不与氢离子反应;
D.偏铝酸根离子与氢离子反应.
解答 解:强酸性溶液中存在大量氢离子,
A.HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.K+、Fe2+、SO42-、Br-之间不反应,在酸性条件下也不反应,在溶液中能够大量共存,故C正确;
D.AlO2-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
7.Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的反应类型是( )
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |
4.下列氧化还原反应中,水作为氧化剂的是( )
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
1.向含有amol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液发生反应的离子方程式,其中正确的是( )
| A. | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C. | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D. | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
18.现有反应CO(g)+H2O(g)?CO2(g)+H2(g);△H<0,在850℃时K=1.在一个体积可变的密闭容器中充入 1molCO、3mol H2O、1mol CO2、和xmol H2,下列说法中不正确的是( )
| A. | 900℃时,该反应的平衡常数K<1 | |
| B. | 850℃时,若x=5,则起始时反应向逆反应方向进行 | |
| C. | 850℃时,若要使上述反应开始时向正反应方向进行,则x应满足0≤x<3 | |
| D. | 850℃时,已知x>3,则随着x的增大,H2的转化率一定始终增大 |