题目内容
(1)在标准状况下,体积为11.2L 的SO2的物质的量 mol、质量 g,其所含原子的总数是 ,所含O原子数为 .
(2)等物质的量O2和臭氧(O3),所含的分子数之比为 ,所含的氧原子数之比为 ,所含的质量之比为 .
(2)等物质的量O2和臭氧(O3),所含的分子数之比为
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)标况下,气体摩尔体积是22.4L/mol,根据n=
、m=nM、N=nNA结合分子构成计算;
(2)根据N=nNA计算其分子个数之比,再结合分子构成计算其原子个数之比,根据m=nM计算其质量之比.
| V |
| Vm |
(2)根据N=nNA计算其分子个数之比,再结合分子构成计算其原子个数之比,根据m=nM计算其质量之比.
解答:
解:(1)标况下,气体摩尔体积是22.4L/mol二氧化硫的物质的量=
=0.5mol,质量=0.5mol×64g/mol=32g,分子数=0.5mol×NA/mol=0.5NA,每个分子中含有3个原子,所以其原子总数为1.5NA,每个分子中含有两个O原子,所以其氧原子个数为NA,
故答案为:0.5;32;9.03×1023或1.5NA;6.02×1023或NA;
(2)根据N=nNA知,二者的物质的量相等,所以其分子个数相等,即分子数之比为1:1,氧气分子中含有2个O原子、臭氧分子中含有3个O原子,所以其氧原子个数之比为2:3,根据m=nM知其质量之比等于摩尔质量之比=32g/mol:48g/mol=2:3,
故答案为:1:1;2:3;2:3.
| 11.2L |
| 22.4L/mol |
故答案为:0.5;32;9.03×1023或1.5NA;6.02×1023或NA;
(2)根据N=nNA知,二者的物质的量相等,所以其分子个数相等,即分子数之比为1:1,氧气分子中含有2个O原子、臭氧分子中含有3个O原子,所以其氧原子个数之比为2:3,根据m=nM知其质量之比等于摩尔质量之比=32g/mol:48g/mol=2:3,
故答案为:1:1;2:3;2:3.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量之间的关系式是解本题关键,侧重考查分析、计算能力,注意气体摩尔体积的适用范围及适用条件,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、用坩埚蒸发溶液时直接将水分蒸干 |
| B、分液时下层液体下放,上层液体上倒 |
| C、向待测液中加入盐酸酸化的氯化钡溶液,出现白色沉淀,待测液中一定含有SO42- |
| D、向待测液中加入稀盐酸,生成使澄清的石灰水变浑浊的无色无味的气体,待测液中一定含有CO32- |
在一定条件下,反应2HI(g)?H2(g)+I2(g(正反应吸热)达到平衡时,要使混合气体的颜色加深,有以下措施:①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强,其中可采取的有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
将标准状况下aLHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将标准状况下,将22.4L NH3气体溶于83mL水中,所得溶液密度为0.88g/cm3,则此溶液的物质的量浓度(mol/L)为( )
| A、8.0 mol/L |
| B、8.8 mol/L |
| C、9.0 mol/L |
| D、9.2 mol/L |
现有pH=3的醋酸和pH=3的硫酸两种溶液,下列有关这两种溶液的叙述正确的是( )
| A、两溶液中水电离出的c(H+)=1×10-11mol?L-1 |
| B、加水稀释100倍后两溶液pH仍相同 |
| C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相同 |
| D、两溶液中分别加入足量锌片放出H2体积相同 |
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A、a=4 |
| B、Y是四氧化三铁,是氧化产物 |
| C、每有3mol Fe2+参加反应,反应中转移的电子总数为5mol |
| D、将Y均匀分散到水中形成的体系可以发生电泳现象 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
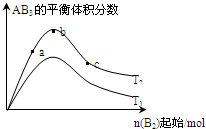

| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |