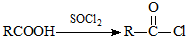题目内容
某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验
(1)若按所得的结论分析,甲观察到的实验现象是 .
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥.同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点.
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3) Ksp[Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3.经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z?nH2O.为确定沉
淀物的具体组成,他设计RU图装置进行实验(所有夹持装置已省略).
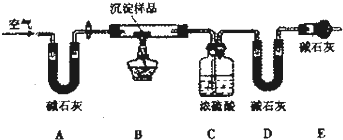
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③ ;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量.
(5)装置E中碱石灰的作用是 .
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
(6)分析实验数据可知,第 组出现误差较大的数据,应舍去.由实验数据计算得该白色沉淀物的组成为 (选填序号).
a.Mg2(OH)2CO3?3H2O b.Mg(OH)2(CO3)2?3H2O
c.Mg4(OH)2(CO3)3?3H2O d.Mg5(OH)4(CO3)3?2H2O.
| 同学甲 | 同学乙 | |
| 实验方案 | 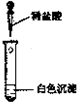 | 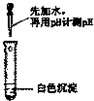 |
| 实验现象 | ||
| 实验结论 | 只有MgCO3 | 只有Mg(OH)2 |
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥.同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点.
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)
淀物的具体组成,他设计RU图装置进行实验(所有夹持装置已省略).

(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量.
(5)装置E中碱石灰的作用是
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
| 实验序号 | 沉淀样品质量 | CO2的物质质量/mol | H2O的物质的量/mol |
| 1 | 3.64 | 0.03 | 0.04 |
| 2 | 7.28 | 0.06 | 0.08 |
| 3 | 10.92 | 0.09 | 0.16 |
a.Mg2(OH)2CO3?3H2O b.Mg(OH)2(CO3)2?3H2O
c.Mg4(OH)2(CO3)3?3H2O d.Mg5(OH)4(CO3)3?2H2O.
考点:探究物质的组成或测量物质的含量,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验探究和数据处理题
分析:碳酸镁可以和盐酸反应生成氯化镁水以及二氧化碳;氢氧化镁属于弱碱,可以和盐酸反应生成氯化镁和水,
(1)根据碳酸镁与稀盐酸反应生成氯化镁、水和CO2,但是氢氧化镁和盐酸反应没有该现象;
(2)沉淀表面有吸附的氯离子,可以通过检验氯离子来判断沉淀是否洗涤干净;
(3)氢氧化镁的溶度积常数小于碳酸镁的溶度积常数;
(4)空气中水蒸气和CO2通过碱石灰时可以被吸收;
(5)D吸收的是反应产生的二氧化碳,不允许空气中的水以及二氧化碳的干扰;
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去,根据表中数据可知CO2与水蒸气的物质的量之比是3:4,据此回答.
(1)根据碳酸镁与稀盐酸反应生成氯化镁、水和CO2,但是氢氧化镁和盐酸反应没有该现象;
(2)沉淀表面有吸附的氯离子,可以通过检验氯离子来判断沉淀是否洗涤干净;
(3)氢氧化镁的溶度积常数小于碳酸镁的溶度积常数;
(4)空气中水蒸气和CO2通过碱石灰时可以被吸收;
(5)D吸收的是反应产生的二氧化碳,不允许空气中的水以及二氧化碳的干扰;
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去,根据表中数据可知CO2与水蒸气的物质的量之比是3:4,据此回答.
解答:
解:碳酸镁可以和盐酸反应生成氯化镁水以及二氧化碳,氢氧化镁属于弱碱,pH略大于7,可以和盐酸反应生成氯化镁和水,据现象可以鉴别二者,故答案为:
沉淀溶解,有气泡产生;pH>7,沉淀逐渐溶解;
(1)碳酸镁与稀盐酸反应生成氯化镁、水和CO2,因此实验现象是沉淀溶解,有气泡产生,故答案为:沉淀溶解,有气泡产生.
(2)由于沉淀表面有吸附的氯离子,所以可以通过检验氯离子来判断沉淀是否洗涤干净,即取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀即证明没有洗涤干净,故答案为:取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀.
(3)由于氢氧化镁的溶度积常数小于碳酸镁的溶度积常数,所以Ksp(MgCO3)>Ksp[Mg(OH)2],故答案为:>;
(4)由于装置中有残留的空气,而空气中通过碱石灰时水蒸气和CO2被吸收,所以因此先通入一会儿空气,再加热,故答案为:先通入一会儿空气,再加热.
(5)由于空气中还含有水蒸气和CO2会进入装置D干扰实验,所以E装置中碱石灰的作用是防止空气中的水蒸气和CO2进入装置D,故答案为:防止空气中的水蒸气和CO2进入装置D.
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去,根据表中数据可知CO2与水蒸气的物质的量之比是3:4,则
a.Mg2(OH)2CO3?3H2O中CO2与水蒸气的物质的量之比是1:4,a不正确;
b.Mg(OH)2(CO3)2?3H2O中CO2与水蒸气的物质的量之比是1:2,b不正确;
c.Mg4(OH)2(CO3)3?3H2O中CO2与水蒸气的物质的量之比是3:4,c正确;
d.Mg5(OH)4(CO3)3?2H2O中CO2与水蒸气的物质的量之比是3:4,但3.64g该物质得不到0.03molCO2,d不正确,
答案选c.
故答案为:3;c.
沉淀溶解,有气泡产生;pH>7,沉淀逐渐溶解;
(1)碳酸镁与稀盐酸反应生成氯化镁、水和CO2,因此实验现象是沉淀溶解,有气泡产生,故答案为:沉淀溶解,有气泡产生.
(2)由于沉淀表面有吸附的氯离子,所以可以通过检验氯离子来判断沉淀是否洗涤干净,即取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀即证明没有洗涤干净,故答案为:取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀.
(3)由于氢氧化镁的溶度积常数小于碳酸镁的溶度积常数,所以Ksp(MgCO3)>Ksp[Mg(OH)2],故答案为:>;
(4)由于装置中有残留的空气,而空气中通过碱石灰时水蒸气和CO2被吸收,所以因此先通入一会儿空气,再加热,故答案为:先通入一会儿空气,再加热.
(5)由于空气中还含有水蒸气和CO2会进入装置D干扰实验,所以E装置中碱石灰的作用是防止空气中的水蒸气和CO2进入装置D,故答案为:防止空气中的水蒸气和CO2进入装置D.
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去,根据表中数据可知CO2与水蒸气的物质的量之比是3:4,则
a.Mg2(OH)2CO3?3H2O中CO2与水蒸气的物质的量之比是1:4,a不正确;
b.Mg(OH)2(CO3)2?3H2O中CO2与水蒸气的物质的量之比是1:2,b不正确;
c.Mg4(OH)2(CO3)3?3H2O中CO2与水蒸气的物质的量之比是3:4,c正确;
d.Mg5(OH)4(CO3)3?2H2O中CO2与水蒸气的物质的量之比是3:4,但3.64g该物质得不到0.03molCO2,d不正确,
答案选c.
故答案为:3;c.
点评:考查涉及实验方案设计与评价、物质检验、实验数据处理等方面的知识,难度大,综合性强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将标准状况下aLHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A、a=4 |
| B、Y是四氧化三铁,是氧化产物 |
| C、每有3mol Fe2+参加反应,反应中转移的电子总数为5mol |
| D、将Y均匀分散到水中形成的体系可以发生电泳现象 |
下面是一些排列无序的物质,请将下列各物质填写到下列树状分类法图中相应的位置上:Cu、H2、NaCl溶液、CaO、H2O、Hg、S、Ca(OH)2、H2SO4、CaCO3、NH3?H2O、CH3COOH


某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
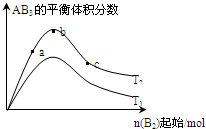

| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |
 甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
 .
.