题目内容
14.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液,下列操作正确的是( )| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸,标准液的浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故A错误;
B.锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故B错误;
C.滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故C错误;
D.读数时,视线与滴定管内液体的凹液面最低处保持一致,操作正确,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)不变,故D正确;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
7.下列有关物质的性质或应用的说法不正确的是( )
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
8.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.下列有关该电池的说法正确的是( )
| A. | 充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O | |
| B. | 充电时每转移2 mol电子,阴极有1 mol Cd(OH)2被氧化 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
2.填写如表
(1)
(2)画出下列粒子的结构示意图:S2-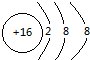 Mg2+
Mg2+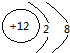 .
.
(1)
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 | |
| ① | ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ② | 3818Ar | 18 | 20 | 18 | 38 |
| ③ | 3216S2- | 16 | 16 | 18 | 32 |
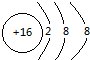 Mg2+
Mg2+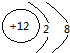 .
.
9.温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气)?pC(气),达到平衡后,若将混合气体的体积压缩到原来的$\frac{1}{2}$,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中正确的是( )
| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |
19.短周期元素A、B、C、D在周期表中的位置如图所示,E+与D的简单阴离子有相同的电子层结构,D元素原子的次外层电子数等于其它电子层数之和,下列说法正确的是( )
| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
6.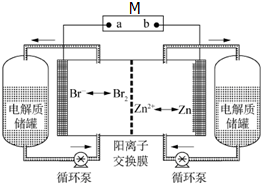 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环流动.左侧电极为惰性电极.放电时M是用电器,充电时M是外电源.下列说法不正确的是( )| A. | 锌溴液流电池总反应为:Zn+Br2═ZnBr2 | |
| B. | 放电时右侧电池电极发生氧化反应,电流从a极经用电器流向b极 | |
| C. | 放电时Zn2+从右侧经阳离子交换膜移向左侧,左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时左侧溴离子浓度下降,左侧电池电极连接电源的负极 |
3.NA为阿伏伽德罗常数,下列说法错误的是( )
| A. | 1molNa与O2反应得到32g固体产物,钠失去电子数为NA | |
| B. | 用1mL0.1mol•L-1FeCl3溶液制得的氢氧化铁胶体所含胶粒数为10-4NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,22.4LCH4中含有的碳原子数为NA |
