题目内容
19.短周期元素A、B、C、D在周期表中的位置如图所示,E+与D的简单阴离子有相同的电子层结构,D元素原子的次外层电子数等于其它电子层数之和,下列说法正确的是( )| A | B | C |
| D |
| A. | C的非金属性最强,可分别与A、E元素形成离子化合物 | |
| B. | 元素D可形成三种常见的酸,且酸根离子均能促进水的电离 | |
| C. | C单质可以从D、E组成的化合物的水溶液中置换出D | |
| D. | 离子半径由大到小的顺序为:D>E>A>B>C |
分析 短周期元素A、B、C、D四种元素,D元素原子的次外层电子数等于其他层电子数之和,由位置可知D位于第三周期,则次外层电子数为8,M层电子数为8-2=6,则D为S,B为O,结合位置关系A为N,C为F,E2+与D的简单阴离子有相同的电子层结构,则E为Ca,然后结合元素化合物性质来解答.
解答 解:短周期元素A、B、C、D四种元素,D元素原子的次外层电子数等于其他层电子数之和,由位置可知D位于第三周期,则次外层电子数为8,M层电子数为8-2=6,则D为S,B为O,结合位置关系A为N,C为F,E2+与D的简单阴离子有相同的电子层结构,则E为Ca,
A.F的非金属性最强,可与Ca元素形成离子化合物,但是与N形成共价化合物,故A错误;
B.S对应的酸有亚硫酸、硫酸、氢硫酸,硫酸根离子不能促进水的电离,故B错误;
C.C单质是F2,F2会与水反应,不能从D、E组成的化合物的水溶液中置换出D,故C错误;
D.电子层越多,半径越大,电子层结构相同时,序数小半径反而大,
D的离子是S2-(3层、16号),E的离子是Ca 2+(3层、20号),A的离子是N 3-(2层、7号),B的离子是O 2-(2层、8号),C的离子是F-(2层、9号),
则离子半径由大到小的排列顺序为:D>E>A>B>C,故D正确;
故选:D.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素周期表结构、元素周期律内容为解答的关键,注意氟气与水的反应,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
12.下列有关化学用语表示正确的是( )
| A. | 中子数为79、质子数为55 的铯(Cs)原子:${\;}_{55}^{79}$Cs | |
| B. | N2分子的电子式: | |
| C. | HOCH2COOH缩聚物的结构简式: | |
| D. | 镁离子的结构示意图: |
14.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液,下列操作正确的是( )
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
4.对烷烃CH3CH(C2H5)CH(CH3)2的命名,正确的是( )
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
11. 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
装置B中发生的反应为C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
合成反应:
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀得到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分转入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,试管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验时没有装置D c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
 1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如图装置合成1,2-二溴乙烷.装置B中发生的反应为C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
产物和部分反应物的相关数据如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
在冰水浴冷却下将20.0mL浓硫酸与10.0mL95%乙醇混合均匀得到反应液,取出10.0mL加入三颈烧瓶B中,剩余部分转入滴液漏斗A中.E的试管中加入8.0g液溴,再加入2-3mL水,试管外用水冷却.断开D、E之间的导管,加热B,待装置内空气被排除后,连接D和E,继续加热并保持温度在170-180℃,打开滴液漏斗活塞,缓慢滴加反应液,直至反应完毕.
分离提纯:
将粗产物分别用10%的氢氧化钠溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,得到纯净的1,2-二溴乙烷6.3g.
回答下列问题:
(1)混合浓硫酸与乙醇时,加入试剂的正确顺序是先加乙醇,再加浓硫酸;使用冰水浴降温的目的是防止乙醇挥发.
(2)为防止暴沸,装置B中还应加入碎瓷片;C的作用是平衡气压;E中试管里加水的目的是防止溴、产物1,2-二溴乙烷挥发.
(3)判断生成1,2-二溴乙烷反应结束的方法是E中试管里的液体变为无色;反应结束时正确的操作是断开DE之间的导管,再停止加热.
(4)洗涤和分离粗产物时使用的玻璃仪器是分液漏斗、烧杯.
(5)本实验中,1,2-二溴乙烷的产率为67%.
(6)下列操作中,将导致产物产率降低的是abc(填正确答案的标号).
a.乙烯通入溴时迅速鼓泡 b.实验时没有装置D c.去掉装置E烧杯中的水 d.装置F中NaOH溶液用水代替.
8.下列各选项有机物数目,与分子式为ClC4H7O2 且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(  )的一氯代物 )的一氯代物 | D. | 立体烷 ( )的二氯代物 )的二氯代物 |
9.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2,5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断试样的pH约为4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”).
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”).
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.

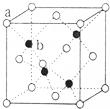 已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题:
已知A、B、C、D、E为元素周期表前四周期原子序数依次增大的元素,A原子核外有三个能级,每个能级上电子数相同,B原子的最外层p轨道的电子数为半充满结构,C、D为同主族元素,且D的原子序数是C的2倍,E2+的3d轨道上有10个电子.请回答下列问题: