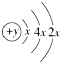题目内容
以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是( )
| A、漂白粉 | B、烧碱 |
| C、硝酸铵 | D、玻璃 |
考点:玻璃的主要化学成分、生产原料及其用途,铵盐
专题:
分析:A、煅烧石灰石得到氧化钙,氧化钙溶于水得到氢氧化钙,电解食盐水得到氯气,氯气与氢氧化钙反应制得漂白粉;
B、电解饱和食盐水得到氢氧化钠;
C、电解水得到氢气,氢气与氮气反应生成氨气,氨气与氧气反应生成NO和水,NO、氧气和水反应生成硝酸,氨气和硝酸反应生成硝酸铵;
D、生产玻璃的原料有纯碱、石灰石、石英.
B、电解饱和食盐水得到氢氧化钠;
C、电解水得到氢气,氢气与氮气反应生成氨气,氨气与氧气反应生成NO和水,NO、氧气和水反应生成硝酸,氨气和硝酸反应生成硝酸铵;
D、生产玻璃的原料有纯碱、石灰石、石英.
解答:
解:A、煅烧石灰石得到氧化钙,氧化钙溶于水得到氢氧化钙,电解食盐水得到氯气,氯气与氢氧化钙反应制得漂白粉,故A不选;
B、电解饱和食盐水得到氢氧化钠,故B不选;
C、电解水得到氢气,氢气与氮气反应生成氨气,氨气与氧气反应生成NO和水,NO、氧气和水反应生成硝酸,氨气和硝酸反应生成硝酸铵,故C不选;
D、生产玻璃的原料有纯碱、石灰石、石英,上述原料不能生产玻璃,故D选;
故选D.
B、电解饱和食盐水得到氢氧化钠,故B不选;
C、电解水得到氢气,氢气与氮气反应生成氨气,氨气与氧气反应生成NO和水,NO、氧气和水反应生成硝酸,氨气和硝酸反应生成硝酸铵,故C不选;
D、生产玻璃的原料有纯碱、石灰石、石英,上述原料不能生产玻璃,故D选;
故选D.
点评:本题考查了化工产品的制备,难度中等,掌握物质的性质是解题的关键.

练习册系列答案
相关题目
在密闭容器中,反应xA(g)?yB(g)达到平衡后,保持温度不变,将容器体积增加为原来的二倍,当达到新的平衡时,B的浓度是原来的70%,则( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、物质B的质量分数减少了 |
| D、x>y |
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
| A、一定有SO42- |
| B、可能有SO42-或Ag+ |
| C、一定无Ag+ |
| D、还可能有CO32- |
室温,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
当前我国环保急待解决的“白色污染”通常指的是( )
| A、金属冶炼厂的白色烟尘 |
| B、石灰窑的白色粉尘 |
| C、聚乙烯等塑料垃圾 |
| D、白色建筑废料 |
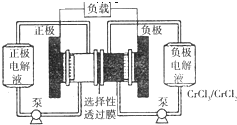 铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ | 放电 |
| 充电 |
| A、电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D、电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol?L-1 |
在溶液导电性实验装置里,分别注入同体积同浓度的H2SO4溶液与Ba(OH)2溶液,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A、灯光明暗程度不变 |
| B、灯光变暗或不亮 |
| C、灯光变亮 |
| D、无法判断 |
几难溶物质的有关数值如表所示:下列关于含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 |
| B、该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4 |
| C、当pH=10时,溶液中c(Fe2+):c(Fe3+)=2×1020:1 |
| D、向该溶液中加入适量氨,调节pH到9.6后过滤,将所得的沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
 A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为:
A、B、C、D四种短周期元素,且A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3和BC2,A、D同主族,A的原子结构示意图为: