题目内容
室温,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-4 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应HZ+Y-═HY+Z-不能发生 |
| C、此温度下,1 mol/L HZ溶液的pH=2 |
| D、此温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,结合强酸制取弱酸分析解答.
解答:
解:A、相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,故A错误;
B、由A知,HZ的酸性大于HY,根据强酸制取弱酸知,HZ+Y-═HY+Z-能发生,故B错误;
C、Ka(HZ)=10-4,因为HZ的电离程度很小,其浓度变化可以忽略,则 10-4=
=
,c(H+)=10-2mol/L,pH=2,故C正确;
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选C.
B、由A知,HZ的酸性大于HY,根据强酸制取弱酸知,HZ+Y-═HY+Z-能发生,故B错误;
C、Ka(HZ)=10-4,因为HZ的电离程度很小,其浓度变化可以忽略,则 10-4=
| [H+]?[Z-] |
| [HZ] |
| [H+]2 |
| 1 |
D.相同温度下,同一物质的电离平衡常数不变,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确相同温度下电离平衡常数与电解质强弱的关系是解本题关键,易错选项是D,注意温度不变,同一物质的电离平衡常数不变,与溶液的浓度无关,为易错点.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列包装标识贴错了的是( )
| 选项 | A | B | C | D |
| 物质 | 浓硫酸 | 酒精 | 小苏打 | 氯酸钾 |
| 标识 |  |  |  |  |
| A、A | B、B | C、C | D、D |
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中加入过量的氯化钙溶液
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中加入过量的稀硫酸
④向石灰水中通入过量CO2.
①向饱和碳酸钠溶液中加入过量的氯化钙溶液
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中加入过量的稀硫酸
④向石灰水中通入过量CO2.
| A、①② | B、②⑤ | C、①③ | D、③⑤ |
以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是( )
| A、漂白粉 | B、烧碱 |
| C、硝酸铵 | D、玻璃 |
目前,科学家正在研究开发一种高能电池--钠硫电池,它以熔融钠、硫为两极,以导电的β-A2lO3陶瓷作固体电解质,反应式如下:Na2SX
2Na+xS以下说法正确的是( )
| ||
| 放电 |
| A、放电时,Na作正极,S极发生还原反应 |
| B、放电时,Na发生还原反应 |
| C、充电时,钠极与外电源的正极相连 |
| D、充电时,阳极发生的反应为:SX2--2e=xS |
下列说法正确的是( )
| A、离子化合物中可能含有共价键 |
| B、极性分子中不含有非极性键 |
| C、非极性分子一定含有有非极性键 |
| D、共价化合物中可能含有含有离子键 |
如图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是( )


| A、该硫酸的物质的量浓度为9.2mol/L |
| B、常温下1mol铁与足量的该硫酸反应产生3g氢气 |
| C、配制500ml 4.6mol/l的稀硫酸需取该硫酸125ml |
| D、配制稀硫酸时,先向烧杯中加入浓硫酸,再沿玻璃棒慢慢加入适量水,且边加边搅拌 |
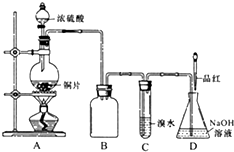 某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.
某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.