题目内容
16.为了配制100mL1mol/L的NaOH溶液,其中有下列几个操作,错误的是( )①NaOH用称量纸盛装进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH在烧杯里刚完全溶解时,立即将溶液转移到容量瓶;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切.
| A. | ①③⑤ | B. | ①⑤ | C. | ②③⑤ | D. | ①② |
分析 ①NaOH固体具有腐蚀性,应放在烧杯进行称量;
②依据配制溶液体积选择容量瓶规格,容量瓶定容时仍需要加蒸馏水;
③容量瓶为精密仪器,不能盛放过热液体;
④根据烧杯沾有溶质,应将溶质全部转移到容量瓶中;
⑤依据定容的正确操作解答;
解答 解:①NaOH固体具有腐蚀性,应放在烧杯进行称量,故错误;
②配制100mL1mol/L的NaOH溶液,应选择100mL容量瓶,因为容量瓶定容时仍需要加蒸馏水,所以使用前不需要干燥,故正确;
③NaOH溶于水放热,所以不能立即把溶液转移到容量瓶中,故错误;
④用蒸馏水洗涤烧杯内壁2次,洗涤液也均转入容量瓶中,是为了将溶质全部转移到容量瓶中,故正确;
⑤定容时为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故错误;
故选:A.
点评 本题主要考查了配制一定物质的量的溶液的配制方法和注意事项,明确配制原理及容量瓶使用方法即可解答,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
6.对于常温下0.1mol•L-1氨水和0.1mol•L-1醋酸,下列说法正确的是( )
| A. | 0.1 mol•L-1氨水,溶液的pH>13 | |
| B. | 0.1 mol•L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO-) | |
| D. | 0.1 mol•L-1醋酸与0.1 mol•L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
11.利用电渗析法淡化海水时,得到淡水的部分( )
| A. | 阴极区 | B. | 阳极区 | C. | 中间区 | D. | 水区均得到 |
1.下列关于二氧化硅的叙述正确的是( )
| A. | 二氧化硅熔点高,硬度大,存在于水泥、陶瓷中 | |
| B. | 二氧化硅用于制造晶体管、集成电路 | |
| C. | 二氧化硅用于制造石英钟表的压电材料和光导纤维 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
8.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为0.4<b≤1.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
 ;
; .
. 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: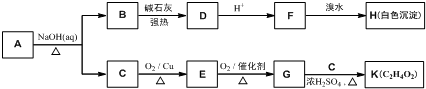

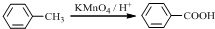
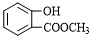 .
.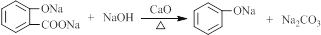 .
.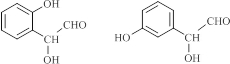 (写结构简式).
(写结构简式).


