题目内容
在100mL BaCl2和KCl的混合溶液中加入a mol Na2SO4溶液,恰好使Ba2+完全沉淀:如加入b mol AgNO3溶液,恰好使Cl-完全沉淀,则该混合溶液中K+浓度为( )
| A、0.1(2a-b)mol/L |
| B、0.1(b-2a)mol/L |
| C、10(b-2a)mol/L |
| D、10(2a-b)mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据反应Ba2++SO42-═BaSO4↓计算钡离子的物质的量,据此确定原溶液中氯化钡中氯离子的物质的量,再利用Ag++Cl-═AgCl↓计算溶液中氯离子的总物质的量,用氯离子总物质的量-氯化钡中氯离子物质的量即可求得KCl中氯离子物质的量,然后计算原混合溶液中钾离子物质的量浓度即可.
解答:
解:根据Ba2++SO42-═BaSO4↓,可知:n(Ba2+)=n(SO42-)=amol,故氯化钡中Cl离子物质的量为2amol,
根据反应Ag++Cl-═AgCl↓,则:n(Cl-)=n(AgNO3)=bmol,
则原溶液中含有KCl:n(KCl)=(b-2a)mol,原混合溶液中钾离子物质的量浓度为:
=10(b-2a)mol/L,故答案为C.
根据反应Ag++Cl-═AgCl↓,则:n(Cl-)=n(AgNO3)=bmol,
则原溶液中含有KCl:n(KCl)=(b-2a)mol,原混合溶液中钾离子物质的量浓度为:
| (b-2a)mol |
| 0.1L |
点评:本题考查了有关物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及表达式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
下列有关晶体的说法中正确的是( )
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |

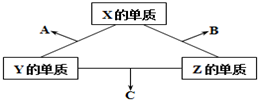 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题: