题目内容
18.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
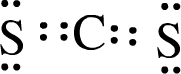 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
分析 短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,然后依据元素及其单质、化合物的性质来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为P,W为S,
(1)X位于元素周期表中的第二周期IVA族,故答案为:第二周期IVA族;
(2)上述元素的化合物中,硫化氢与浓硫酸可发生氧化还原反应,故答案为:S;
(3)X为C,其最外层4个电子,W为S,其最外层6个电子,XW2的电子式为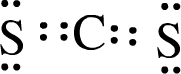 ,故答案为:
,故答案为: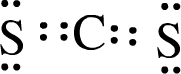 ;
;
(4)P的最高价为+5价,则最高价氧化物对应的水化物的化学式为H3PO4,故答案为:H3PO4;
(5)W 和Y形成的一种二元化合物具有色温效应,N、S的原子个数比为1:1时且W的质量分数约为70%,其相对分子质量在170-190之间,则$\frac{190}{32+14}$≈4,该化合物的化学式为S4N4,故答案为:S4N4.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,(5)为解答的难点,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
8.下列有关元素周期表的意义与作用错误的是( )
| A. | 根据元素在周期表中的位置,推测元素的原子结构 | |
| B. | 指导新元素的发现和合成,预测新元素的性质 | |
| C. | 在金属与非金属的分界线附近寻找半导体材料 | |
| D. | 在零族元素中寻找耐腐蚀的金属材料 |
9.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
13.应用元素周期律的有关知识进行的下列预测中,正确的是( )
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体.
| A. | ①③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③ |
10.下列说法不正确的是( )
| A. | CH3CH=CHCH3,分子中的四个碳原子在同一直线上 | |
| B. | 乙醛能使溴水出现褪色觋象,是因为乙醛发生了氧化反应 | |
| C. | 在酸性条件下,CH3CO18OCH2CH3的水解产物是CH3COOH和CH3CH218OH | |
| D. | 聚合物(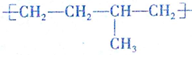 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
7.1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确的是( )
| A. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| B. | 加入NaOH溶液的体积是50mL | |
| C. | 浓硝酸在与合金反应中起了酸性和氧化性的双重作用 | |
| D. | 得到的金属氢氧化物的沉淀为3.12克 |
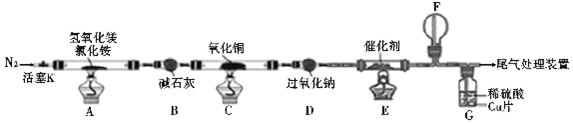
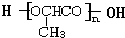 +(n-1)H2O.
+(n-1)H2O.
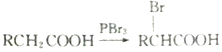
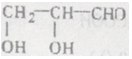 (己知同一个碳原子上不能连接2个羟基)
(己知同一个碳原子上不能连接2个羟基)