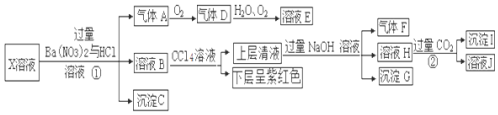
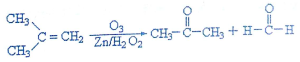题目内容
7.1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确的是( )| A. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| B. | 加入NaOH溶液的体积是50mL | |
| C. | 浓硝酸在与合金反应中起了酸性和氧化性的双重作用 | |
| D. | 得到的金属氢氧化物的沉淀为3.12克 |
分析 A.根据c=$\frac{1000ρw}{M}$计算该浓硝酸的物质的量浓度;
B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),由钠离子守恒n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算;
C.起氧化性的硝酸生成NO2气体,起酸性的硝酸生成硝酸根;
D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,根据二氧化氮计算转移电子物质的量,氢氧化物质量等于金属质量与氢氧根质量之和.
解答 解:A.密度为1.40g/cm3、质量分数为63%的浓硝酸的物质的量浓度=$\frac{1000×1.4×63%}{63g/mol}$mol/L=14mol/L,故A正确;
B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO2)=n(HNO3),则n(NaNO3)=0.05L×14mol/L-$\frac{1.792L}{22.4L/mol}$=0.62mol,由钠离子守恒n(NaOH)=n(NaNO3)=0.62mol,故需要1.0mol/L NaOH溶液体积为$\frac{0.62mol}{1mol/L}$=0.62L=620mL,故B错误;
C.起氧化性的硝酸生成NO2气体,起酸性的硝酸生成硝酸根,所以浓硝酸在与合金反应中起了酸性和氧化性的双重作用,故C正确;
D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,即氢氧根的物质的量为0.08mol×(5-4)=0.08mol,故氢氧化物质量=1.76g+0.08mol×17g/mol=3.12g,故D正确,
故选B.
点评 本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 136.8kJ | B. | 110.9kJ | C. | 83.2kJ | D. | 82.4kJ |
| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
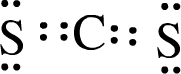 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
| A. | 苯与浓硫酸、浓硝酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照的条件下反应主要生成2,4-二氯甲苯 | |
| C. | 苯酚与浓溴水反应生成2,4,6-三溴苯酚 | |
| D. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
| 成分 | 质量(g) | 摩尔质量(mol•L-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
(2)配制过程中,下列操作配制结果没有影响的是AD(填字母).
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
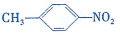 和
和