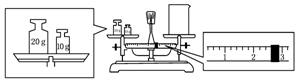
题目内容
18.合成氨工业是煤化工产业链中非常重要的一步.已知有一组数据:破坏1mol氮气中的化学键需要吸收A kJ能量;破坏0.5mol氢气中的H-H键需要吸收B kJ的能量;形成氨分子中1mol N-H键能够释放C kJ能量.则合成2mol氨气热量变化为6C-A-6BkJ.分析 反应热等于生成物总键能与反应物总键能之差,结合反应计算反应放出的热量,以此解答该题.
解答 解:合成2mol氨气,需要1mol氮气和3mol氢气反应,为破坏1mol氮气和3mol氢气中化学键所吸收的能量,等于AkJ+6BkJ,
形成氨分子中1mol N-H键能够释放C kJ能量,则形成2mol氨气,可形成6molN-H键,放出6CkJ能量.
则放出的能量为(6C-A-6B)kJ.
故答案为:6C-A-6B.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力和计算能力,注意把握反应热与键能的关系,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
18.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为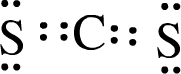 .
.
(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
| X | Y | |
| Z | W |
(1)元素X在周期表中的位置为第二周期IVA族.
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是S(写元素符号).
(3)XW2的电子式为
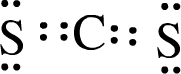 .
.(4)Z 的最高价氧化物对应的水化物的化学式为H3PO4.
(5)W 和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为S4N4.
10.下列描述与元素周期律不相符的是( )
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
7.下列各组物质及粒子性质变化不正确的是( )
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
8.下列有关金属及其合金的说法中,不正确的是( )
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |