题目内容
3.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)C元素基态原子的电子排布图
 .
.(3)C单质分子的电子式为
 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
分析 常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
根据以上分析进行解答.
解答 解:常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
(1)E为Fe元素,其基态核外电子排布式为:1s22s22p63s23p63d64s2,铁元素位于第4周期第VIII族,故答案为:第4周期第VIII族;
(2)N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道表示式为 ,故答案为:
,故答案为: ;
;
(3)氮气的电子式为 ,由于氨分子间存在氢键,故使其沸点出现反常,故答案为:
,由于氨分子间存在氢键,故使其沸点出现反常,故答案为: ;NH3分子间易形成氢键;
;NH3分子间易形成氢键;
(4)D的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,共热能发生反应,生成一种气体单质,应为Cl2,反应的方程式为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O;
(5)由A、B两种元素组成的含4个原子的非极性分子为乙炔,直线型sp杂化;13g乙炔的燃烧完全燃烧放出的热量为600kj,所以乙炔的燃烧热为1200kJ∕mol,则乙燃烧热的热化学反应方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200 kJ/mol,故答案为:sp杂化;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200 kJ/mol.
点评 本题考查结构性质位置关系应用,题目难度中等,涉及元素在周期表中的位置、电子式等知识,注意掌握原子结构与元素周期表、元素周期律的关系.

下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条
 件下进行):
件下进行):| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol•Lˉ1 KI溶液 | H2O | 0.01 mol•Lˉ1 X 溶液 | 0.1 mol•Lˉ1 双氧水 | 1 mol•Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(2)已知,I2与X反应时,两者物质的量之比为1:2.按面表格中的X和KI的加入量,加入V(H2O2)>0.5mL,才确保看到蓝色.
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)实验3表明:硫酸铁能提高反应速率.催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
(5)环境友好型铝-碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)$?_{充电}^{放电}$2AlI3(s).含I-传导有机晶体合成物作为电解质,该电池负极的电极反应为:Al-3e-+3I-=AlI3,充电时Al连接电源的负极.
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)H2(g)+1/2O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
试写出NO与CO催化转化成N2和CO2的热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ•mol-1
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂对上述转化反应的作用,用气体传感器测得不同时间的NO和CO浓度如下:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol•L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v (N2)=1.875×10-4mol/L.s.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
(3)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时分别发生以下反应:
18NO(g)+2C3H6(g)?9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g);
并分别测定各温度下经相同时间时的NOx转化率,绘得图象如图1所示:
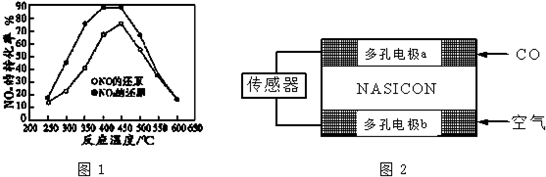
①分析图中信息可以得出的结论是
结论一:由NOX转化率数据可判断,相同温度下NO的转化率比NO2低(填“高”或“低”)
结论二:在250°C~450°C时,NOx转化率随温度升高而增大,450°C~600°时NOx转化率随温度升高而减小或两反应为放热反应
②在上述NO2和C3H6的反应中,能提高NO2转化率的措施有BC.(填序号)
A.加入催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
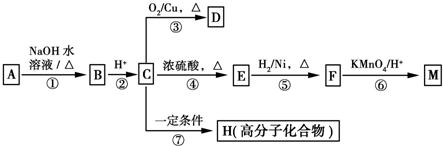
(4)CO分析仪以燃料电池为工作原理,其装置如图2所示.该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.工作时多孔电极a的电极反应方程式为CO+O2--2e-=CO2.
.
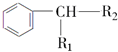 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)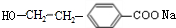 .
.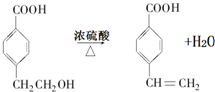 .
.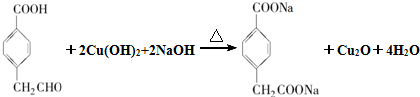 .
.