题目内容
15.下列有关离子方程式,正确的是( )| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
分析 A.得失电子不守恒;
B.NH4HCO3溶液与少量NaOH浓溶液,是碳酸氢根首先和氢氧根反应;
C.碳酸氢根离子水解生成碳酸和氢氧根离子;
D.三价铁离子能氧化碘离子.
解答 解:A.稀硝酸和过量的铁屑反应离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故A错误;
B.NH4HCO3溶液与少量NaOH浓溶液,是碳酸氢根首先和氢氧根反应,其离子方程式:HCO3-+OH-=CO32-+H2O,故B正确;
C.碳酸氢根离子水解生成碳酸和氢氧根离子,碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?H2CO3+OH-,故C错误;
D.三价铁离子能氧化碘离子,离子方程式为2Fe(OH)3+6H++2I-=I2+2Fe2++6H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,明确离子反应实质是解题关键,注意离子方程式遵循客观事实、原子个数、电荷数守恒规律,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.根据有机化合物的系统命名法,下列命名正确的是( )
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  邻羟基苯甲酸 邻羟基苯甲酸 |
3.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是第4周期第VIII族.
(2)C元素基态原子的电子排布图 .
.
(3)C单质分子的电子式为 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)C元素基态原子的电子排布图
 .
.(3)C单质分子的电子式为
 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
10.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得:101kPa时,H2的燃烧热为285.8kJ•mol-1,CH4的燃烧热为890.3kJ•mol-1.下列热化学方程式书写正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
20.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2]<(填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
7.设阿伏加德罗常数(NA)的数值为nA,下列说法不正确的是( )
| A. | 1mol Cl2与足量Fe反应,转移的电子数为2nA | |
| B. | 19.2g纯铜理论上可以制得纯净的硝酸铜的物质的量为0.3NA | |
| C. | 1.8 gAl与足量的盐酸反应放出的氢气为0.1NA | |
| D. | 0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA |
5.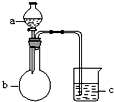 用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )
用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )
 用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )
用如图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系不正确的是一组是( )| 选项 | a | b | c | 现象 | 结论 |
| A | 饱和食盐水 | 碳化钙 | 酸性KMnO4溶液 | c中溶液紫色褪去 | 乙炔具有还原性 |
| B | 浓盐酸 | KMnO4固体 | NaBr溶液 | c中溶液由无色变橙色 | Cl2的氧化性比Br2强 |
| C | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
| D | 硫酸 | Na2SO3固体 | 品红溶液 | c中溶液红色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: (1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.
(1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.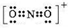 ,其等电子体有N2O、CO2(至少2种).
,其等电子体有N2O、CO2(至少2种).