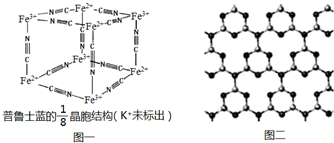
题目内容
12.在含有I-离子且滴加酚酞显红色的溶液中,能大量共存的离子组是( )| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
分析 滴加酚酞显红色的溶液中存在大量氢氧根离子,
A.铵根离子与氢氧根离子反应;
B.亚铁离子、铝离子与氢氧根离子反应;
C.四种离子之间不发生反应,都不与碘离子、氢氧根离子反应;
D.次氯酸根离子能够氧化碘离子.
解答 解:滴加酚酞显红色的溶液中存在大量氢氧根离子,
A.NH4+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.Fe2+、Al3+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.Cl-、SO32-、Na+、K+之间不反应,都不与I-、OH-反应,在溶液中能够大量共存,故C正确;
D.ClO-具有氧化性,能够氧化I-,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
3.常见元素A、B、C、D、E的原子序数依次增大,其相关信息如表:
(1)E位于元素周期表的位置是第4周期第VIII族.
(2)C元素基态原子的电子排布图 .
.
(3)C单质分子的电子式为 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
(2)C元素基态原子的电子排布图
 .
.(3)C单质分子的电子式为
 ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.(4)D的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O.
(5)由A、B两种元素组成的非极性分子有多种,其中乙是一个含4个原子的分子,乙分子的中心原子的杂化方式为sp杂化.已知13g乙完全燃烧放出的热量为600kj,则乙燃烧热的热化学反应方程式是C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1200kJ/mol.
20.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2]<(填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:<(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:②>①
(3)碳酸氢钠是一种强(填“强”或“弱”)电解质;常温下,0.1mol/L碳酸氢钠溶液的pH大于8,试用离子方程式表达其原因,该溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②几种离子开始沉淀时的pH下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
7.设阿伏加德罗常数(NA)的数值为nA,下列说法不正确的是( )
| A. | 1mol Cl2与足量Fe反应,转移的电子数为2nA | |
| B. | 19.2g纯铜理论上可以制得纯净的硝酸铜的物质的量为0.3NA | |
| C. | 1.8 gAl与足量的盐酸反应放出的氢气为0.1NA | |
| D. | 0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA |
17.下列说法正确的是( )
| A. | 六方最密堆积和面心立方最密堆积的原子堆积方式,空间利用率最高 | |
| B. | 分子晶体中,分子间作用力越大,分子越稳定 | |
| C. | 熔点:BaO>CaO>NaCl>KCl | |
| D. |  某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子个数之比是1:2:1 |
1.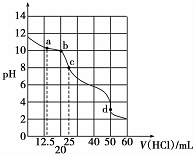 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO3-)>c(OH-) | B. | b点:5c(Cl-)>4c( HCO3-)+4c(CO32-) | ||
| C. | c点:c( OH -)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=c(CO32-)+c( HCO3-)+c(OH -) |
 .
.
 (1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.
(1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.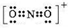 ,其等电子体有N2O、CO2(至少2种).
,其等电子体有N2O、CO2(至少2种).