题目内容
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,100g98%硫酸溶液中含有的氧原子数为4NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可与盐酸反应产生44.8LH2 | |
| C. | 标准状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
分析 A、硫酸溶液中溶质和溶剂中都含有氧原子;
B、依据生成氢气计算得到物质的量,结合反应中电子守恒计算电子转移数;
C.标准状况下,2.24L CO和CO2混合气体物质的量n=$\frac{2.24L}{22.4L/mol}$=0.1mol,一氧化碳和二氧化碳都含一个碳原子;
D.氯气溶于水只有一部分发生氧化还原反应;
解答 解:A、硫酸溶液中溶质和溶剂中都含有氧原子,100g98%硫酸溶液中含有的氧原子数大于4NA,故A错误;
B、依据生成氢气反应中电子转移计算分析,标准状况下,当活泼金属转移2NA个电子时,2H++2e-=H2↑,可从盐酸中置换产生22.4L H2,故B错误;
C.标准状况下,2.24L CO和CO2混合气体物质的量n=$\frac{2.24L}{22.4L/mol}$=0.1mol,一氧化碳和二氧化碳都含一个碳原子,0.1mol CO和CO2混合气体含有的碳原子数目为0.1NA ,故C正确;
D.0.1molCl2溶于水氯气溶于水只有一部分发生氧化还原反应,Cl2与水发生反应转移的电子数目小于0.1NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析、氧化还原反应电子转移数计算、可逆反应分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
9.原子序数依次增大的元素b、c、d,它们的最外层电子数分别为6、7、1.b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素的非金属性次序为c>b | |
| B. | c和d形成的化合物存在离子键 | |
| C. | 最高价氧化物对应水化物的酸性:c>b | |
| D. | 离子半径:d+>c- |
7.下列说法中正确的是( )
| A. | 含有羟基的化合物一定属于醇类化合物 | |
| B. | 醇类化合物的官能团是跟链烃基相连的 | |
| C. | 96%的乙醇跟过量的Na混合,加热蒸馏可制得无水乙醇 | |
| D. | 白酒瓶标鉴上的“28°”是指含水28%(体积分数) |
4.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定不含有K+ | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | |
| D. | 向无色溶液中加入稀盐酸无现象,再加入BaCl2有白色沉淀生成,则该溶液中一定含有SO42- |
1.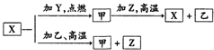 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |
18.化学与生活、生产密切相关,下列说法不正确的是( )
| A. | 食盐可做调味剂、防腐剂 | |
| B. | 硅酸钠可做木材防火剂的原料 | |
| C. | 二氧化硫在葡萄酒中起漂白作用 | |
| D. | 还原铁粉可用于食品包装袋内的脱氧剂 |

 ,请回答下列问题:
,请回答下列问题: .
. (写结构简式,一种即可).
(写结构简式,一种即可). 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选). .
.