题目内容
1.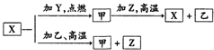 X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )
X、Y、Z是中学化学中常见的三种单质,Y、Z为气体,点燃化合成乙,X的一种离子遇苯酚溶液呈紫色( )| A. | Y是Cl2、Z是H2 | |
| B. | 甲为Fe3O4 | |
| C. | X2+能使苯酚呈紫色 | |
| D. | 甲与Z高温下反应的化学方程式为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O |
分析 X、Y、Z是中学化学中常见的三种单质,X的一种离子遇苯酚溶液呈紫色,则X为Fe,Y、Z为气体,点燃化合成乙,而Fe与乙在高温下发生置换反应生成甲与Z,甲为Fe元素化合物,甲与Z高温下发生置换反应得到Fe与乙,可推知乙为H2O,甲是Fe3O4,Y为O2,Z是H2.
解答 解:X、Y、Z是中学化学中常见的三种单质,X的一种离子遇苯酚溶液呈紫色,则X为Fe,Y、Z为气体,点燃化合成乙,而Fe与乙在高温下发生置换反应生成甲与Z,甲为Fe元素化合物,甲与Z高温下发生置换反应得到Fe与乙,可推知乙为H2O,甲是Fe3O4,Y为O2,Z是H2.
A.由上述分析可知,Y为O2,Z是H2,故A错误;
B.由上述分析可知,甲是Fe3O4,故B正确;
C.Fe3+能使苯酚呈紫色,Fe2+不能使苯酚呈紫色,故C错误;
D.甲与Z高温下反应的化学方程式为4H2+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O,故D错误.
故选:B.
点评 本题考查无机物推断,“X的一种离子遇苯酚溶液呈紫色”是推断突破口,熟练掌握Fe元素单质化合物性质.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
1.已知1mol氢气完全燃烧生成水蒸气时放出热量242kJ,且氢气中1mol H-H键完全断裂时吸收热量436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键断裂时吸收热量为( )
| A. | 920kJ | B. | 496kJ | C. | 436kJ | D. | 188kJ |
2.M、Q、R、V为分别占有前3周期的元素.其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14,下列说法中正确的是( )
| A. | 单质的沸点:M>Q | |
| B. | Q元素的阴离子和V元素的阴离子都只有还原性 | |
| C. | M、Q、R、V四种元素组成的化合物的水溶液可以是碱性、中性和酸性 | |
| D. | Q与R可以组成2种离子化合物 |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,100g98%硫酸溶液中含有的氧原子数为4NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可与盐酸反应产生44.8LH2 | |
| C. | 标准状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
13.《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”.下列说法错误的是( )
| A. | 鸡屎矾中含有极性共价键 | |
| B. | 铜盐溶液可与铁发生置换反应 | |
| C. | 碱式碳酸铜不稳定,受热易分解 | |
| D. | 鸡屎矾投苦酒中发生的是氧化还原反应 |
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷定,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的过程中有氧化还原反应发生 | |
| D. | 该冶炼锌的方法属于热还原法 |
 .
.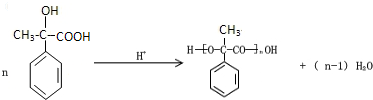 .
.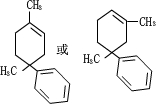 (任写一种)
(任写一种)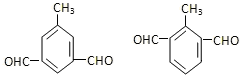 .
. .
.